|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Relativistické efekty v atomu
Dana a Rudolf Mentzlovi
Počátek minulého století dal vzniknout dvěma teoriím, které aspirují na post vládce světa. Obě popisují náš svět s přesností, která je ověřena na počet desetinných míst o mnoho převyšující všechny naše reálné potřeby. Přesto víme, že alespoň jedna z nich není správně. Kvantová teorie i teorie relativity, o kterých je tu řeč, ztrácejí na svém lesku tam, kde se potkávají. Na velice malých škálách předvídají hodnoty rostoucí nade všechny meze, a proto… a proto se pojďme podívat tam, kde se tyto dvě teorie vhodně doplňují a vysvětlují, proč je zlatoZlato – aurum, chemicky odolný, velmi dobře tepelně i elektricky vodivý, ale poměrně měkký drahý kov žluté barvy. Již od dávnověku byl používán pro výrobu dekorativních předmětů, šperků a jako měnová záruka při emisích bankovek. V současné době je navíc důležitým materiálem v elektronice, kde je ceněna jeho vynikající elektrická vodivost a odolnost proti korozi. V přírodě se vyskytuje zejména ryzí. žluté, rtuťRtuť – Hydrargyrum, těžký, toxický kovový prvek. Slouží jako součást slitin (amalgámů) a jako náplň různých přístrojů (teploměry, barometry). Je jediným kovem, který je za normálních podmínek kapalný. tekutá, wolframovéWolfram – Wolframium, šedý až stříbřitě bílý, velmi těžký a mimořádně obtížně tavitelný kov. Hlavní uplatnění nalézá jako složka různých slitin, v čisté formě se s ním běžně setkáváme jako s materiálem pro výrobu žárovkových vláken. Wolfram byl objeven roku 1781 švédským chemikem Wilhelmem Scheelem. vlákno se v žárovce nevypaří nebo prostě jen to, proč nás atmosférický kyslíkKyslík – Oxygenium, plynný chemický prvek, tvoří druhou hlavní složku zemské atmosféry. Je biogenním prvkem a jeho přítomnost je nezbytná pro existenci většiny živých organizmů na naší planetě. V atmosféře tvoří plynný kyslík 21 objemových %. Kromě obvyklých dvouatomových molekul O2 se kyslík vyskytuje i ve formě tříatomové molekuly jako ozon O3. Produkty hoření se nazývají oxidy, dříve kysličníky. Kyslík je třetím nejhojnějším prvkem ve vesmíru. již dávno nespálil, jak by podle tradičního pohledu měl.

Fotografie jediného zářícího atomu stroncia pořízená Davidem Nadlingerem, doktorským studentem Oxfordské univerzity. Za fotografii získal první cenu EPSRC (2018). Atom (tečka uprostřed) je excitován laserem, proto svítí.
|
Bílé zlato – slitina zlata s jiným kovem. Mezi příměsemi musí být alespoň jeden bílý kov, typicky nikl nebo paládium. Barva slitiny je také bílá. Atom – základní strukturní jednotka hmoty, jádro je složeno z neutronů a protonů, obaly z elektronů. Rozměry atomu jsou 10−10 m, rozměry jádra 10−14 m, hustota atomu je 1011 g·cm−3, hustota jádra 1014 g·cm−3. Elektrony nejsou v atomárnáím obalu lokalizovány, můžeme určit jen pravděpodobnosti jejich výskytu v tzv. orbitalech. Singletový stav – stav kvantového systému, například elektronového obalu molekuly, při kterém jsou všechny spiny spárovány. Celkový spin je nula a multiplicita stavu je rovna 1. Tripletový stav – stav kvantového systému, například elektronového obalu molekuly, ve kterém je celkový spin roven jedné a multiplicita rovna třem. Zářivý přechod molekul z tripletového stavu do singletového základního stavu je vzhledem dlouhým časům relaxace označovaný jako fosforescence. Skutečnost, že se molekula kyslíku za pokojové teploty vyskytuje v tripletovém stavu, umožňuje výskyt kyslíkové atmosféry na Zemi, neboť tento stav je z hlediska chemické kinetiky málo reaktivní. |
Atomy a relativita
V bulletinu AB 14/2019 jsme uvedli, že rychlost elektronuElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. v atomárním obalu vodíkuVodík – Hydrogenium, je nejlehčí a nejjednodušší plynný chemický prvek, tvořící převážnou část hmoty ve vesmíru. Má široké praktické využití jako zdroj energie, redukční činidlo při chemické syntéze a v metalurgii nebo jako náplň balonů a vzducholodí. Vodík objevil roku 1766 Henry Cavendish. dosahuje hodnoty 2 200 km/s. Zároveň jsme důtklivě upozornili, že tato mechanistická představa nekoresponduje se skutečností a slouží pouze k vytvoření povšechné představy. Přesto, nebo právě proto, chvíli u této představy zůstaňme. Vodík je nejlehčí prvek s nejmenšími přitažlivými silami mezi jádrem a obalem, a přesto tu rychlost elektronu dosahuje téměř jednoho procenta rychlosti světla. V atomech, jejichž jádra obsahují více protonůProton – částice složená ze tří kvarků (duu) se spinem 1/2, hmotností 1,673×10−27 kg (938 MeV) a elektrickým nábojem +1,6×10−19 C. Proton je na běžných časových škálách stabilní, pokud se rozpadá, je poločas rozpadu větší než 1035 let. Za objevitele protonu je považován Ernest Rutherford, který v roce 1911 objevil atomové jádro při analýze rozptylu částice alfa pronikající tenkou zlatou fólií. Samotná jádra vodíku (protony) detekoval v roce 1918 při ostřelování dusíku částicemi alfa. Antiproton byl objeven v roce 1955 Emilio Segrem a Owenem Chamberlainem., panují mnohem větší síly, a tedy i rychlosti elektronů. Například u jádra s protonovým číslem Z = 80 (rtuť) můžeme dopočítat, že rychlost je 58 % rychlosti světla. To už je hodnota, u které nemůžeme zanedbat relativistické efekty. Lorentzův faktor γ zde dosahuje hodnoty téměř 1,23 a v tomto poměru se zvýší hmotnost elektronu a zároveň zmenší poloměr dráhy. Je zřejmé, že má smysl sáhnout po modelech, které relativistické efekty zohledňují.
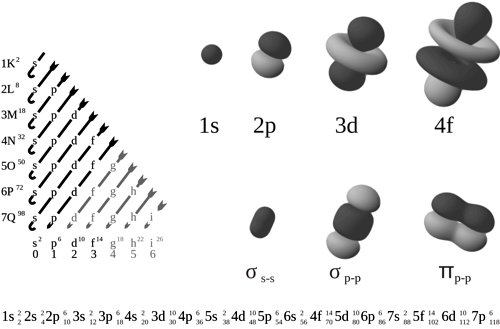
Tvary jednotlivých orbitalů a jejich zaplňování elektrony. Zdroj: Patricia.fidi, Lt Paul.
Korektní modely respektující pravidla kvantové mechaniky poskytují výsledky analogické mechanistickým modelům. Nemluvíme zde o oběžných drahách, nýbrž o orbitalechOrbital – oblast v atomárním či molekulárním obalu, kde se vyskytuje elektron. Pravděpodobnost výskytu elektronu v orbitalu je rovna druhé mocnině velikosti komplexní vlnové funkce. s, p, d a f. I zde se relativistické efekty zvyšují s rostoucím protonovým číslemProtonové číslo Z – udává počet protonů v atomovém jádře prvku. . Nejvíce se samozřejmě deformuje orbit s, který je nejblíže jádru. Vnější orbity d a f jsou již vzdálené, zde se relativita významně neuplatňuje. Tím by se mohlo zdát, že jsme se ocitli na čistě akademické půdě, protože chemická rozmanitost vesmíru je dána právě obsazením vnějších vrstev. Tak uvažoval i sám Paul Dirac, který se zasloužil o začlenění speciální relativity do popisu atomových orbitalů.
Situace je však složitější. Přímými relativistickými efekty je opravdu nejvíce ovlivněna vnitřní vrstva s. U těžkých prvků se nachází mnohem blíže k jádru, než by vyžadovalo klasické nerelativistické pojetí. Tím účinněji však stíní jádro, vnější vrstvy d a f pociťují jeho kladný náboj slaběji a posunují se do větší vzdálenosti. Mluvíme pak o nepřímém relativistickém jevu. Vrstva p zůstává téměř beze změny, nachází se ve vzdálenosti, kde jsou relativistické efekty zhruba kompenzovány stíněním slupkou s. Posun vrstev d a f už nemůže brát chemik na lehkou váhu. Atomy tvoří vazby právě díky elektronům na vnějších orbitalech. Pokud jsou dále od jádra, jsou slaběji vázány a mnohem snáze se excitujíExcitace – proces, při kterém dojde k přechodu na vyšší energetickou hladinu systému. nebo atom opouštějí.
Proč je zlato žluté a rtuť tekutá
Zlato a stříbro se nacházejí ve stejné skupině tabulky prvků, daly by se tedy očekávat podobné rysy. Vnější elektronové hladiny stříbra jsou s atomem pevně svázány a excitovat je lze pouze energetickými fotony, které ve viditelném světleSpektrum – rozklad elektromagnetického záření (většinou světla) na jednotlivé vlnové délky. Zpravidla se provádí za pomoci hranolu nebo mřížky. Spektrum slunečního světla může také vzniknout na vodních kapkách jako duha. Ve spektru se nachází kontinuum (spojitě se měnící barvy) a charakteristické spektrální čáry. Světlé se nazývají emisní (vznikají emisí fotonů) a tmavé absorpční (vznikají absorpcí fotonů). nejsou. Naproti tomu jádro zlata obsahuje o 32 protonů více, valenční elektronyValenční pás – poslední (nejvyšší) pás, ve kterém se vyskytují nějaké elektrony v základním stavu. (u přechodových prvků orbital d) se díky nepřímému relativistickému jevu přiblíží k vodivostnímu pásuVodivostní pás – interval energií, při kterých nejsou elektrony vázány ke konkrétním jádrům a mohou se pohybovat v látce volně. natolik, že je lze excitovat i modrým světlem. Jinými slovy, vnější elektronové slupky jsou schopny pohlcovat modré světlo, které v odraženém světle chybí. Proto se zlato třpytí žlutě.
Ještě vyšší atomové číslo má rtuť. Zde je orbital s deformovaný ještě více, kdežto orbital p zůstává na svém místě. Důležité je, že právě tyto dva orbitaly se podílejí na vazbách kovové mřížky. Ta je tím silnější, čím více se orbitaly překrývají. U rtuti je již jejich vzájemná vzdálenost příliš velká, síly jsou slabé, a proto je rtuť kapalná i při teplotách hluboko pod bodem mrazu. Je paradoxní, že tentýž efekt u prvků, jako je třeba wolfram, naopak způsobuje odolnost vůči vysokým teplotám. Je to proto, že u těchto prvků se na vazbách podílejí slupky d, které se díky nepřímým relativistickým jevům roztahují a mohou se lépe překrývat.

Ralph de Laer Kronig (1904–1995), asistent
Wolfganga Pauliho. Zdroj: Wikipedie.
Spin
V roce 1925, ve snaze vysvětlit některé aspekty chování atomu, navrhl student Ralph Kronig další kvantovou vlastnost – rotaci – a nazval ji spin. Jeho učitel Wolfgang Pauli takový přístup zavrhl. Správně předpokládal, že zavádění čistě mechanistických představ do kvantové teorie je cesta do pekel. Nicméně několik málo měsíců poté přišli se stejnou myšlenkou nizozemští fyzikové Georg E. Uhlenbeck a Samuel A. Goudsmit a jejich myšlenka se okamžitě ujala. Pravdu měli všichni. SpinSpin – vlastní (vnitřní) rotační moment částice souvisící s Lorentzovou symetrií. Pro částici v centrálním poli se přirozeným způsobem skládá s momentem hybnosti. Částice s nenulovým spinem se mohou chovat jako elementární magnetické dipóly μ, aniž by měly elektrický náboj. Takové částice reagují na vnější magnetická pole. je důležitá kvantová vlastnost, ale je nesprávné ji považovat za rotaci, tak jak ji známe z makrosvěta. O tři roky později problém definitivně vyřešil Paul Dirac. Když do rovnic popisujících chování částic zavedl relativistické efekty, objevila se v jeho výpočtech zcela přirozeným způsobem nová vlastnost, kterou nebylo obtížné se spinem ztotožnit.
Elektrony se v orbitalech usazují po dvojicích, ale vždy s opačnou projekcí spinuPauliho vylučovací princip – „Dva fermiony nemohou být nikdy ve stejném kvantovém stavu“. Právě proto různé elektrony v atomárním obalu zaujímají různé kvantové stavy a tím vytvářejí různorodé chování chemických prvků. . Zaujímají tzv. singletový stavSingletový stav – stav kvantového systému, například elektronového obalu molekuly, při kterém jsou všechny spiny spárovány. Celkový spin je nula a multiplicita stavu je rovna 1. vyznačující se tím, že má nulový magnetický moment. Tak zní jedno ze základních kvantových přikázání, se kterým by se nedalo nic dělat, kdyby se tu neuplatňovaly relativistické jevy. Díky nim se může občas stát, že oba spiny míří stejným směrem. Tento stav se nazývá tripletovýTripletový stav – stav kvantového systému, například elektronového obalu molekuly, ve kterém je celkový spin roven jedné a multiplicita rovna třem. Zářivý přechod molekul z tripletového stavu do singletového základního stavu je vzhledem dlouhým časům relaxace označovaný jako fosforescence. Skutečnost, že se molekula kyslíku za pokojové teploty vyskytuje v tripletovém stavu, umožňuje výskyt kyslíkové atmosféry na Zemi, neboť tento stav je z hlediska chemické kinetiky málo reaktivní.. Tyto jevy se uplatňují například při fosforescenci. Ze školy si pamatujeme jednoduchý princip: elektron absorbuje foton, přeskočí na vyšší energetickou hladinu a při zpětném přeskoku kvantum opět vyzáří. To je sice v hrubých obrysech pravda, ale nevysvětluje se tím, jak je možné, že fosforeskování trvá tak dlouho. Proces je složitější. Po excitaci nemusí elektron nutně kvantum vyzářit, ale může se jeho energie zbavit přechodem do tripletového stavu. Tento přechod se děje pomocí tzv. spinorbitální interakceLS vazba – spin-orbitální interakce. Každý objekt má orbitální (l) a spinový (s) moment hybnosti. V kvantové teorii se oba momenty skládají do výsledného momentu hybnosti, který je charakterizován kvantovým číslem j nabývajícím hodnot od |l−s| do |l+s|., při které vstupuje do hry kombinace magnetického pole daného spinem a magnetického pole vytvořeného orbitálním pohybem. Takový proces lze správně vysvětlit pouze akceptováním relativistických efektů. Důležité je, že přechod mezi tripletovým s a singletovým stavem je velmi málo pravděpodobný, a tak může trvat i minuty.

Pamětní deska na budově, kde Otto Stern a Walter Gerlach provedli zlomový experiment, kterým potvrdili existenci spinu a jeho kvantového chování. Mezi reliéfy vědců je schematicky zobrazeno uspořádání pokusu. Foto: Frank Behnsen (2010).
Při pátrání po tripletových stavech nemusíme chodit daleko. Obyčejná molekula kyslíku se po většinu času nachází v tripletovém stavu. Můžeme za to být jen rádi, protože v tomto stavu nemůže reagovat. Při reakcích musí nejprve přijmout energii a obrátit spin. To pochopitelně reakci zpomaluje, a jen tomu vděčíme za snadno ověřitelný fakt, že jsme dosud neshořeli. Kyslík v základním stavu je neporovnatelně reaktivnější. Proto se při opalování tak snadno spálíme. Ultrafialové fotonyUltrafialové záření – elektromagnetické záření s kratší vlnovou délkou, než má viditelné světlo, v rozsahu od 1 nm do 400 nm. Ultrafialové záření objevil v roce 1801 Johann Wilhelm Ritter. Značí se UV z anglického UltraViolet, rozděluje se na extrémní XUV (EUV) (1÷31 nm), daleké VUV (FUV) (10÷200 nm), hluboké DUV (pod 300 nm), krátkovlnné (pod 280 nm), středněvlnné UVB (280÷320 nm), dlouhovlnné UVA (320÷400 nm) a blízké NUV (200÷400 nm). dopadající na tělo mohou překlopit molekuly organického barviva v kůži do tripletového stavu, jehož energii barvivo ochotně poskytne tripletovému kyslíku, a ten se tím dostane do svého základního agresivního stavu. Lékaři si povšimli této vlastnosti a využívají ji při léčení některých typů nádorů. Nádory, které mají schopnost vázat ve svém okolí tato barviva, jsou ozařovány vhodným světlem převádějícím elektrony do tripletového stavu. Kyslík obsažený ve tkáni přejde do singletového stavu a nemocné buňky zničí.
Relativistické procesy, bez kterých by popis atomu byl nejen neúplný, ale často vyloženě chybný, jsou dobře zmapovány téměř sto let. Přesto tu stále leží hozená rukavice čekající na experimentátory, kteří ji snad někdy zvednou. Těžké prvky nacházející se v periodické tabulce daleko za uranemUran (prvek) – radioaktivní chemický prvek, kov, patří mezi aktinoidy. Prvek objevil v roce 1789 Martin Heinrich Klaproth, v čisté formě byl uran izolován roku 1841 Eugene-Melchior Peligotem. Izotop 235 se využívá jako palivo v jaderných elektrárnách. Je pojmenován po planetě Uran. zatím známe jen z urychlovačů nebo jsou pouze teoreticky předpovězeny. Ty, které již potvrzeny byly, žijí příliš krátce a máme jich tak málo, že nemůžeme ověřit jejich chemické vlastnosti. Výzva, o které píšeme, nespočívá jen ve vylaďování technologie, nýbrž v ověření, zda periodická tabulka platí i v oblastech, kde jsou zatím lvi. Relativistické efekty by tu měly být tak silné, že by nemělo docházet k uspořádání prvků do skupin.
Odkazy
- Prof. Dr. Martin Kaupp: Einstein in der Chemie; Spektrum, 18 Nov 2005
- Fernando Carrillo Hermosilla: ?Por qué el oro es amarillo y el cobre rojo?; Universidad de Castilla – La Mancha, 29 Jan 2017
- Por Migui: La relatividad es más cotidiana de lo que piensas; NAUKAS, 28 Sep 2011
- Javier Corpas y Darío Barreiro: El mercurio y el oro...gente relativa; El electrón manco, 21 Aug 2015
- Wikipedie: Ralph Kronig
