|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Radiace, která léčí – část čtvrtá
David Zoul
V tomto závěrečném dílu minisérie věnované teleterapiiTeleterapie – část radioterapie, při níž se zdroj záření nalézá vně ozařované tkáně a v definované vzdálenosti od povrchu těla pacienta. se seznámíme s ozařováním i jinými druhy částic, než jsou fotonyFoton – základní kvantum energie elektromagnetického záření, polní částice elektromagnetické interakce. Má nulovou klidovou hmotnost a nemá elektrický náboj. Jeho energie a hybnost jsou přímo úměrné frekvenci záření (E = ħω, p = E/c). Stav fotonu zahrnuje také polarizaci, protože jde o příčné vlnění. Kvantování energie poprvé zavedl Max Planck při pokusech o vysvětlení záření černého tělesa. Albert Einstein dal těmto kvantům reálný význam v roce 1905 při vysvětlení fotoelektrického jevu. Samotný název foton poprvé pro tuto částici použil až americký fyzikální chemik Gilbert Lewis v dopise časopisu Nature z roku 1926.. V úvodu krátce představíme elektronovouElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. terapii, používanou pro iradiaci nádorových ložisek blízko povrchu těla, jako jsou nádory kůže a podkoží, nádory prsu apod. Poté obrátíme naši pozornost k hadronovéHadrony – částice složené z kvarků, které interagují silnou a slabou jadernou interakcí, pokud jsou nabité, také elektromagneticky. Dělíme je na mezony složené z kvarku a antikvarku a baryony složené ze tří kvarků různých barev. Název je odvozeninou z řeckého hadros (silný, těžký). K nejznámějším mezonům patří piony, k nejznámějším baryonům neutron a proton. Hmotnosti hadronů převyšují hmotnost elektronů o několik řádů. Jejich interakce s látkovým prostředím se výrazně liší jak od elektronů, tak i od fotonů. terapii, která v posledních desetiletích prodělala bouřlivý vývoj a v současnosti představuje nejpokročilejší teleterapeutickou ozařovací metodu. Vedle radioterapie nabitými hadrony se budeme krátce věnovat rovněž současným možnostem neutronovéNeutron – částice složená ze tří kvarků (ddu) se spinem 1/2, hmotností 1,675×10−27 kg (940 MeV) a nulovým elektrickým nábojem. Volné neutrony jsou nestabilní se střední dobou života 886 s (15 minut) a poločasem rozpadu 10 minut. V roce 1930 Walther Bothe a Herbert Becke ostřelovali lehké prvky alfa částicemi a objevili nový druh pronikavého záření. V roce 1932 zjistil James Chadwick, že je toto záření složeno z neutrálních částic přibližné velikosti protonu a objevil tak neutron. radioterapie.
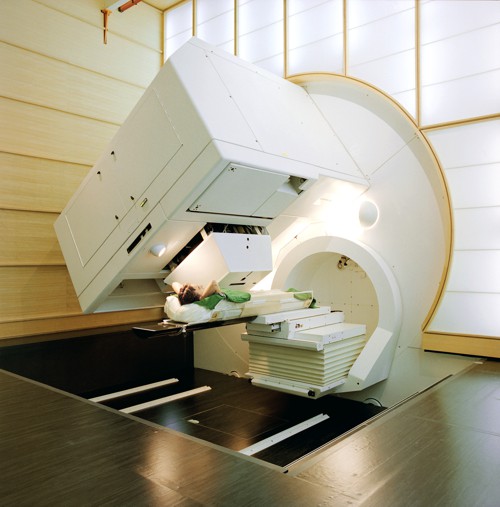
První gantry systémGantry systém – část ozařovače, která zajišťuje rotaci generovaného svazku záření okolo pacienta., který byl vyvinut v roce 1992 v Centru protonové radiační
terapie ve švýcarskím Institutu Paula Scherrera. Zdroj: PSI.
|
Hadrony – částice složené z kvarků, které interagují silnou a slabou jadernou interakcí, pokud jsou nabité, také elektromagneticky. Dělíme je na mezony složené z kvarku a antikvarku a baryony složené ze tří kvarků různých barev. Název je odvozeninou z řeckého hadros (silný, těžký). K nejznámějším mezonům patří piony, k nejznámějším baryonům neutron a proton. Hmotnosti hadronů převyšují hmotnost elektronů o několik řádů. Jejich interakce s látkovým prostředím se výrazně liší jak od elektronů, tak i od fotonů. Kyslíkový efekt – Oxygen Enhancement Ratio, OER. Jedním z významných radiobiologických faktorů je tzv. nepřímý účinek ionizujícího záření spočívající v radiační indukci kyslíkových radikálů, které následně napadají DNA a ničí živé buňky. Tento tzv. zesilující efekt kyslíku (zkráceně kyslíkový efekt) má často rozhodující vliv na úspěšnost protinádorové léčby ionizujícím zářením. Nádorové buňky však naneštěstí bývají často hypoxické, neboť nemají vybudované dostatečně robustní cévní zásobení. Nepřímý účinek ionizujícího záření je tak zasahuje paradoxně méně než okolní zdravé buňky. Po iradiaci se cévní řečiště zásobující nádor ještě více tromboticky uzavírá, což vede k větší hypoxii buněk nádoru a zpomalení jejich růstu, současně však i vyšší radiorezistenci. Relativní biologická účinnost – Relative Biological Effectiveness, RBE, poměr biologické účinnosti jednoho typu ionizujícího záření k druhému, a to při stejnému množství absorbované energie. RBE je empirická hodnota, která se mění v závislosti na typu ionizujícího záření, použitých energiích, uvažovaných biologických účincích nebo kyslíkovém efektu. Termoluminiscenční dozimetrie – TLD, integrující dozimetrická metoda využívající tzv. termoluminiscenční jev v některých materiálech, jako je například fluorid lithný, zubní sklovina apod. Při něm jsou ionizujícím zářením vybuzeny elektrony z valenčního do vodivostního pásu a během deexcitace mohou být zachyceny v kvantových pastech ležících nad energií valenčního pásu. Množství elektronů zachycených v pastech je v určitém rozmezí hodnot úměrné absorbované dávce záření. Elektrony mohou zachycené v pastech setrvat i řadu týdnů. Během rychlého zahřátí na teplotu v řádu několika set °C jsou elektrony z pastí prudce vypuzeny a při návratu do valenčního pásu vyzáří foton ve viditelné oblasti spektra. Množství světla emitovaného zahřívaným TLD je tedy úměrné absorbované dávce. Fotonásobičem je světlo zesíleno, převedeno na elektrický proud a celkový sebraný náboj je následně přepočten na absorbovanou dávku prostřednictvím kalibrační přímky. |
Ozařování elektronovým svazkem
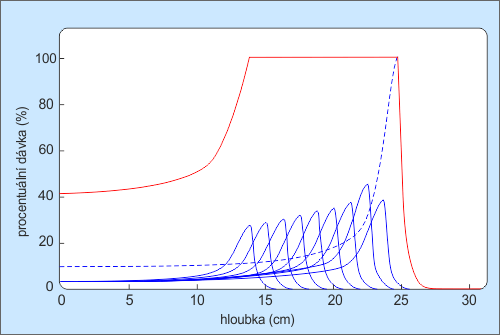
V minulých dílech jsme ukázali, že hloubkové dávkové křivky vysokoenergetických fotonů jsou poznamenány build-up efektemBuild-up effect – fyzikální jev charakteristický pro ozařování nepřímo ionizujícím zářením. V blízkosti povrchu, kterým vstupuje fotonové záření do látky, je vysoká pravděpodobnost, že část energie předané z fotonů na nabité částice (charakterizované veličinou kerma) opět unikne z látky pryč ve formě brzdného, charakteristického, rozptýleného a anihilačního záření. S narůstající hloubkou roste pravděpodobnost, že i tato záření stihnou v látce zainteragovat a předat jí tak svoji energii. Veličina absorbovaná dávka představuje energii, která byla skutečně sdělena (předána) elementu látky, vydělenou hmotností tohoto elementu. Blízko povrchu látky je proto dávka mnohem menší než kerma, a hodnoty obou veličin se k sobě přiblíží až v určité hloubce (hloubce maxima dávky), která je funkcí energie dopadajících fotonů a materiálu látky., v důsledku kterého je povrchová dávka velmi nízká, až téměř nulová. V jisté hloubce, dané energií fotonů, dosahuje svého maxima a následně přibližně exponenciálně klesá. Blíže k povrchu lze absorbovanou dávkuAbsorbovaná dávka – D, energie ionizujícího záření pohlcená při průchodu látkou jednotkovým množstvím hmoty (dE/dm). Jednotkou je jeden gray (Gy = J/kg). U člověka dochází k prvním projevům nemoci z ozáření po celotělové aplikaci dávky 1 Gy, za smrtelnou je považována dávka cca 5 Gy. Dávky nad 100 Gy mohou člověka usmrtit i na místě. zvýšit přiložením tzv. bolusu – tkáni ekvivalentní vrstvy polymerního materiálu, který pro záření imituje živou tkáň. Správnou volbou tloušťky bolusu a energie fotonů docílíme, že povrch kůže pod bolusem se již bude nacházet v hloubce maxima absorbované dávky, a můžeme tak bez problémů ozařovat i nádory kůže a podkoží.
Větší problém u fotonů představuje poměrně pozvolný pokles absorbované dávky za hloubkou maxima – viz obr. 4. Například při ozařování nádorů prsu to představuje faktickou nemožnost použít přímé pole, neboť by absorbovaná dávka v plicích byla nepřípustně vysoká. Používají se proto dvě protilehlá pole tečná (tangenciální) k ploše hrudníku. U přiměřeně velkých prsů to zpravidla nepředstavuje zásadní technický problém, v případě malých prsů či nádorů mužského prsu, však již ano.
V těchto případech přicházejí na pomoc elektronyElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932.. Hloubková dávková křivka elektronů – viz obr. 4 – vykazuje již na povrchu takřka maximum, dosah elektronů ve tkáni je však velmi omezený a hloubková dávka tak po dosažení maxima poměrně strmě klesá. Nádory menších prsů lze prostřednictvím elektronů úspěšně ozařovat z přímých polí, neboť několik málo centimetrů pod povrchem, kde začínají plíce, již absorbovaná dávka poklesne prakticky k nule – viz obr. 1.
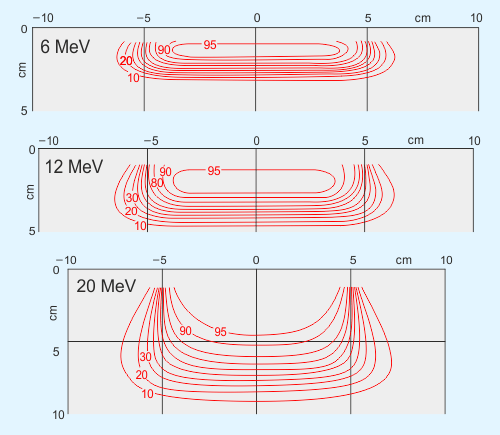
Obr. 1: Hloubkové izodózyIzodóza – plocha v prostoru, kterou charakterizuje všude stejná velikost absorbované dávky, popřípadě dávkového příkonu. elektronů s energií 6 MeV, 12 Mev, 20 MeV
Jak jsme si ukázali v předchozích dílech, lineární urychlovačLINAC – zkratka používaná pro lineární urychlovače (LINear ACcelerator). Příkladem může být první urychlovací předstupeň Velkého hadronového kolideru v CERNu. V případě radioterapeutických účelů někdy užívá zkratky clinac. urychluje primárně elektronový svazek, který může být dále konvertován na brzdné fotonové zářeníBrzdné záření – anglicky a německy bremsstrahlung, jev, kdy při změně velikosti rychlosti nabité částice vzniká elektromagnetické záření. Brzdné zářením je emitováno při změně velikosti vektoru rychlosti. Při změně směru hovoříme o cyklotronním nebo synchrotronním záření., pakliže mu vsuneme do cesty wolframový terčík. V opačném případě vychází z urychlovače přímo elektronový svazek. Ten je velice tenký – tužkový – a pro radioterapeutické účely je nejprve potřeba jej přeměnit v klasický rozbíhavý svazek, jaký vzniká na terčíku v případě fotonů. K tomuto účelu slouží tzv. rozptylující fólie (scattering foils), které urychlovač vkládá do cesty elektronovému svazku prostřednictvím karuselu, podobně, jako flattening filtry v případě fotonů.
Po výstupu z urychlovače je divergentní elektronový svazek potřeba kolimovat na cílový objem prostřednictvím tzv. elektronového aplikátoru. Protože se elektrony dosti silně rozptylují i na atomech vzduchu, musí elektronový aplikátor zasahovat až k povrchu pacienta, aby bylo zaručeno přené vymezení ozařovacího pole.
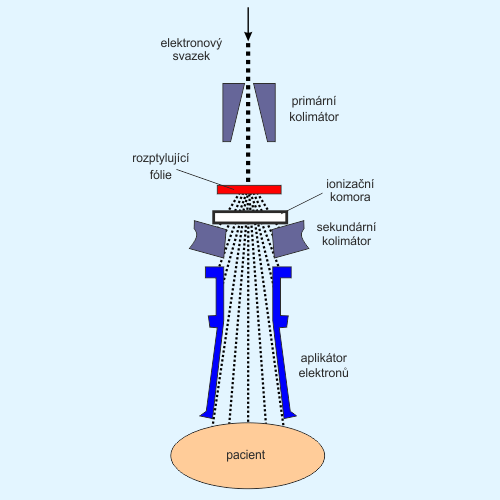
Obr. 2: Schéma principu ozařování elektronovým svazkem
Na konec elektronového aplikátoru se umísťuje tzv. elektronový rámeček, do kterého je pevně vsazen výstupní kolimátor vymezující finální tvar elektronového ozařovacího pole. Tento kolimátor je navržen v plánovacím systému na míru každému pacientovi a speciální CNC zařízení vyhotoví formu, do které se výstupní kolimátor fyzicky odlije z Roseova kovuRoseův kov – slitina tří kovů s velmi nízkou teplotou tání – bismutu, cínu a olova. V metalurgii platí, že slitiny mívají zpravidla nižší teplotu tání než jejich složky. Teplota tání Roseova kovu je necelých 100 °C. Technicky se jedná v podstatě o známý Woodův kov (teplota tání 63 °C), který je pouze ochuzen o toxické kadmium.. Elektronový aplikátor obsahuje čtečku kódu, který je unikátní pro každý elektronový rámeček a tedy pro každého pacienta. Tím je zamezeno možnosti chybného spárování pacienta a výstupního kolimátoru.

Obr. 3: Elektronový aplikátor s detailem elektronového rámečku
s výstupním kolimátorem
Interakce těžkých nabitých částic s prostředím
V konvenční radioterapii se využívá ozařování pomocí fotonových nebo elektronových svazků, jejichž zdrojem bývají lineární urychlovačeLINAC – zkratka používaná pro lineární urychlovače (LINear ACcelerator). Příkladem může být první urychlovací předstupeň Velkého hadronového kolideru v CERNu. V případě radioterapeutických účelů někdy užívá zkratky clinac.. Nejvíce energie je těmito částicemi předáváno tkáním ležícím na povrchu těla nebo těsně pod ním, viz obr. 4. S rostoucí hloubkou průniku do tkáně dochází u fotonů po prudkém počátečním nárůstu k exponenciálnímu poklesu předávané energie. Místa ležící před cílovou oblastí mohou být jednotlivými svazky ozářena více než vlastní ložisko. Určité radiační zátěži jsou vystavena i místa ležící za cílovou oblastí. Ozařováním z více polí lze vliv těchto nepříznivých vlivů do značné míry snížit. Pro mnohé nádory ležící v těsné blízkosti kritických orgánů vede radioterapie konvenčními svazky k vyššímu riziku nepřípustného poškození těchto struktur.
Těžké nabité částice (protonyProton – částice složená ze tří kvarků (duu) se spinem 1/2, hmotností 1,673×10−27 kg (938 MeV) a elektrickým nábojem +1,6×10−19 C. Proton je na běžných časových škálách stabilní, pokud se rozpadá, je poločas rozpadu větší než 1035 let. Za objevitele protonu je považován Ernest Rutherford, který v roce 1911 objevil atomové jádro při analýze rozptylu částice alfa pronikající tenkou zlatou fólií. Samotná jádra vodíku (protony) detekoval v roce 1918 při ostřelování dusíku částicemi alfa. Antiproton byl objeven v roce 1955 Emilio Segrem a Owenem Chamberlainem., alfa částiceAlfa částice – jádro helia, vázaný stav dvou protonů a dvou neutronů. Přirozenou cestou vzniká při alfa rozpadu. Vzhledem k velké vazebné energii jde o vysoce stabilní částici. a další ionty) při průchodu prostředím ztrácejí svoji energii především prostřednictvím srážek s elektrony vázanými v molekulách ozařovaného prostředí. U protonů nemají v terapeuticky využívané oblasti energií (přibližně 50 až 250 MeVElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K.) reakce s atomovými jádry významný vliv. Tyto reakce je však zapotřebí vzít v úvahu pro lehké ionty, například ionty uhlíku. Často při nich dochází ke vzniku sekundárních částic, které podstatně ovlivňují proces předávání energie nabitých částic prostředí. Interakce nabitých částic s prostředím je velmi dobře popsána pomocí Betheho-Blochovy teorie. Tato teorie popisuje nejen ztráty energie, ale i boční rozptyl částice a její dolet.
Urychlené těžké nabité částice při průchodu hmotou ionizují atomy podél své dráhy, a tím postupně ztrácejí svoji kinetickou energii, až svoji dráhu ukončí v hloubce, kterou lze vypočítat v závislosti na druhu a počáteční energii částice, a druhu látky, v níž je energie předávána. Právě ke konci dráhy doletu těžké nabité částice dochází k prudkému nárůstu ionizace, neboť s ubývající rychlostí rychle roste účinný průřez pro rezonanční záchyt částice. V těchto místech tak dochází ke strmému nárůstu dávky. Spádový graf (Braggova křivka) tak vykazuje ke konci dráhy tzv. Braggův pík.
Tvar Braggovy křivky je hlavní principiální výhodou nabitých částic z pohledu jejich terapeutického využití. Těžké nabité částice odevzdávají během průchodu prostředím relativně velmi malou část své energie a většinu energie předají až těsně před koncem své dráhy. Dolet těchto částic je navíc velmi dobře vymezen. Těžké nabité částice dále oproti částicím používaným při konvenčním ozařování téměř nepodléhají bočnímu rozptylu, procházejí tkání prakticky v přímém směru. Dávka v Braggově vrcholu může mít až 2,5krát větší hodnotu (pro záporně nabité ? mezonyPion – mezon π, částice s nulovým spinem složená z kvarků u a d. ), než v oblasti plata Braggovy křivky. Prakticky to znamená, že tkáně, kterými svazek prochází, dostávají 2,5krát menší dávku, než v oblasti Braggova vrcholu, kde se nachází cílový objem.
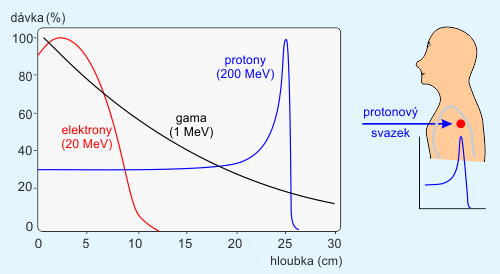
Obr. 4: Vlevo hloubkové dávkové křivky fotonů (černě), elektronů (červeně), protonů (modře). Vpravo princip využití Braggova píku pro transport vysoké dávky do nádorového ložiska v hloubce. Zdroj: [1].
Hadronová terapie – ozařování protony, ionty a nabitými mezony
První ryze medicínské centrum pro protonovou terapii bylo spuštěno již roku 1990 ve městě Loma Linda (Kalifornie, USA). Využití protonů a dalších iontů v léčbě nádorových onemocnění spočívá primárně ve skutečnosti, že tyto částice dovolují velmi přesně vymezit a požadovaným způsobem upravit oblast předávané dávky. Ve srovnání se standardními radioterapeutickými postupy se výrazně zvyšuje poměr dávky v nádoru k integrální dávce v celém těle pacienta. Tím se významně snižuje celkové nežádoucí radiační zatížení zdravých tkání. Lze ozařovat i nádory, které leží v těsné blízkosti důležitých orgánů, a které proto nelze odstranit ani chirurgicky, ani standardními radioterapeutickými postupy.
V oblasti Braggova maxima protonů a zvláště iontů dochází k nárůstu lineárního přenosu energieLET – Linear Energy Tranfer, lineární přenos energie, fyzikální veličina popisující hustotu přenosu energie z částic ionizujícího záření na látkové prostředí: LET = dE/dl., a tedy ke zvýšení jejich relativní biologické účinnostiRelativní biologická účinnost – Relative Biological Effectiveness, RBE, poměr biologické účinnosti jednoho typu ionizujícího záření k druhému, a to při stejnému množství absorbované energie. RBE je empirická hodnota, která se mění v závislosti na typu ionizujícího záření, použitých energiích, uvažovaných biologických účincích nebo kyslíkovém efektu.. Tím je dále zvýrazněn rozdíl mezi ložiskovou a okolní dávkou. Svazky protonů a lehkých iontů tak z principiálního hlediska představují vhodný nástroj pro radioterapeutické využití.
Zejména u lehkých iontů se pak v důsledku vyšší hustoty ionizace, tedy větší hodnoty lineárního přenosu energie (LETLET – Linear Energy Tranfer, lineární přenos energie, fyzikální veličina popisující hustotu přenosu energie z částic ionizujícího záření na látkové prostředí: LET = dE/dl.) snižuje též vliv nepříznivého kyslíkového efektuKyslíkový efekt – Oxygen Enhancement Ratio, OER. Jedním z významných radiobiologických faktorů je tzv. nepřímý účinek ionizujícího záření spočívající v radiační indukci kyslíkových radikálů, které následně napadají DNA a ničí živé buňky. Tento tzv. zesilující efekt kyslíku (zkráceně kyslíkový efekt) má často rozhodující vliv na úspěšnost protinádorové léčby ionizujícím zářením. Nádorové buňky však naneštěstí bývají často hypoxické, neboť nemají vybudované dostatečně robustní cévní zásobení. Nepřímý účinek ionizujícího záření je tak zasahuje paradoxně méně než okolní zdravé buňky. Po iradiaci se cévní řečiště zásobující nádor ještě více tromboticky uzavírá, což vede k větší hypoxii buněk nádoru a zpomalení jejich růstu, současně však i vyšší radiorezistenci.. Tato skutečnost vede k vyšší biologické účinnosti při stejné aplikované dávce. Tento způsob léčby je proto úspěšný i u řady radioresistentních hypoxických nádorů.
V případě lehkých iontů je i za jejich doběhem odevzdávána ozařovanému prostředí určitá energie fragmenty, které vznikají jadernými reakcemi. Boční rozptyl iontů při průchodu prostředím je však nižší než u protonů. Lze tak dosáhnout lepšího vymezení oblasti předávané dávky. Značnou nevýhodou iontů je větší technická náročnost celého zařízení, která se promítá do velikosti a ceny všech komponent.
Radioterapie nádorových onemocnění pomocí hadronových svazků představuje v současné době prověřenou a osvědčenou léčebnou modalitu. Existuje celá řada typů či lokalizací nádorů, pro které je konvenční ozařování méně úspěšné a u kterých přináší protonová terapie vynikající klinické výsledky.
Typy urychlovačů
Centrální jednotkou příslušného onkologického centra využívajícího hadronovouHadrony – částice složené z kvarků, které interagují silnou a slabou jadernou interakcí, pokud jsou nabité, také elektromagneticky. Dělíme je na mezony složené z kvarku a antikvarku a baryony složené ze tří kvarků různých barev. Název je odvozeninou z řeckého hadros (silný, těžký). K nejznámějším mezonům patří piony, k nejznámějším baryonům neutron a proton. Hmotnosti hadronů převyšují hmotnost elektronů o několik řádů. Jejich interakce s látkovým prostředím se výrazně liší jak od elektronů, tak i od fotonů. terapii je urychlovač protonůProton – částice složená ze tří kvarků (duu) se spinem 1/2, hmotností 1,673×10−27 kg (938 MeV) a elektrickým nábojem +1,6×10−19 C. Proton je na běžných časových škálách stabilní, pokud se rozpadá, je poločas rozpadu větší než 1035 let. Za objevitele protonu je považován Ernest Rutherford, který v roce 1911 objevil atomové jádro při analýze rozptylu částice alfa pronikající tenkou zlatou fólií. Samotná jádra vodíku (protony) detekoval v roce 1918 při ostřelování dusíku částicemi alfa. Antiproton byl objeven v roce 1955 Emilio Segrem a Owenem Chamberlainem. nebo lehkých iontů, například alfa částicAlfa částice – jádro helia, vázaný stav dvou protonů a dvou neutronů. Přirozenou cestou vzniká při alfa rozpadu. Vzhledem k velké vazebné energii jde o vysoce stabilní částici., lithiaLithium – nejlehčí ze skupiny alkalických kovů, značně reaktivní, stříbřitě lesklého vzhledu. Jedná se o lehký a měkký kov, který lze krájet nožem. Dobře vede elektrický proud a teplo. Bylo objeveno roku 1817 švédským chemikem Johannem Arfvedsonem. nebo uhlíkuUhlík – Carboneum, chemický prvek, tvořící základní stavební kámen všech organismů. Sloučeniny uhlíku jsou jedním ze základů světové energetiky, kde především fosilní paliva jako zemní plyn a uhlí slouží jako energetický zdroj pro výrobu elektřiny a vytápění, produkty zpracování ropy jsou nezbytné pro pohon spalovacích motorů a silniční dopravu. Výrobky chemického průmyslu na bázi uhlíku jsou součástí našeho každodenního života ať jde o plastické hmoty, umělá vlákna, nátěrové hmoty, léčiva a mnoho dalších.. Energie musí být dostatečná k tomu, aby bylo možné příslušné Braggovo maximum umístit do nádorového ložiska, které se může nacházet i ve značné hloubce pod povrchem těla. Pro protony činí potřebná energie 220 až 250 MeVElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K., v případě iontů je požadovaná energie na nukleon poněkud vyšší.
Radioterapeutické hadronové svazky mohou být v zásadě získávány pomocí tří typů urychlovačů, které se co do principu činnosti od sebe navzájem značně liší. Jedná se o lineární urychlovač, synchrocyklotron a synchrotron.
V lineárním urychlovači lze urychlovat jak protony, tak lehké ionty při dostatečně vysoké intenzitě svazku. Energetický rozptyl urychlených částic je malý a částice lze z urychlovače vyvádět po dostatečně malých energetických balíčcích. Lineární urychlovač je provozně spolehlivý, jeho výroba je technologicky dobře zvládnuta. Je však poměrně náročný na prostor: vzhledem k požadovaným energiím by při obvyklém tempu urychlování protonů 7 MeV/m musel mít délku asi 40 m. Pro lehké ionty by tato délka byla mnohonásobně vyšší, proto se tento typ urychlovače v praxi nepoužívá. Pořizovací i provozní náklady by byly příliš vysoké.
Synchrocyklotron je cyklický urychlovač s jedním magnetem. I při energii protonů 250 MeV je poměrně kompaktní. V zásadě v něm lze urychlovat jak protony, tak lehké ionty. Urychlené částice se z něho vyvádějí pouze při maximální hodnotě energie, při nižší energii z něj částice z principiálních důvodů získávat nelze. Tato okolnost spolu se skutečností, že vyvedený svazek částic má značné příčné rozměry a je rozbíhavý, ztěžuje manipulaci se svazkem a omezuje možnost aktivního skenování, o kterém budu hovořit později. Technologie výroby je velice dobře zvládnuta, provozní spolehlivost je vysoká. Pořizovací i provozní náklady jsou poměrně nízké, nižší než v případě lineárního urychlovače i synchrotronu.
Podstatnou nevýhodou synchrocyklotronu je poměrně značná hmotnost permanentního magnetu (pro protony o energii 250 MeV váží magnet zhruba 90 tun). Z toho důvodu se dnes používají takřka výhradně supravodivé magnety, které jsou sice nákladnější a vzhledem k nutnosti chlazení prodražují také provoz, jsou ale mnohem menší a lehčí. Pro urychlování lehkých iontů na požadované energie se již synchrocyklotron stává kvůli příliš velkým rozměrům nerentabilním.
V synchrotronu, který je také cyklickým urychlovačem, lze urychlovat jak protony, tak lehké ionty za použití stejných magnetů, v téže fokusující soustavě. Urychlované částice obíhají ve vakuovém prstenci tvořeném vakuovou trubicí obklopenou soustavou vychylujících (dipólových) magnetů a fokusujících (kvadrupólových) magnetů. Vychylovací magnety jsou od sebe odděleny přímočarými úseky, ve kterých jsou rozmístěny prvky injekční soustavy, urychlovací vysokofrekvenční soustavy a soustavy extrakce svazku. Růst energie částic a růst magnetického pole ve vychylovacích magnetech je synchronizován, takže částice v synchrotronu zůstávají během urychlování stále na stejné dráze, tzv. rovnovážné orbitě.
Částice lze z tohoto typu urychlovače extrahovat prakticky při libovolné hodnotě energie. Pořizovací náklady synchrotronu jsou nižší než u lineárního urychlovače, ale vyšší než v případě synchrocyklotronu. Výrobní technologie synchrotronu je velmi dobře zvládnuta, provozní spolehlivost je vysoká.
Konstrukční řešení hadronových urychlovačů
Základním typem kruhového urychlovače je cyklotron (první cyklotron vyvinul Ernest Orlando Lawrence již v roce 1932), jeho princip je schematicky znázorněn na obr. 5. Mezi póly silného elektromagnetu jsou v ploché vakuové komoře upevněny dva duté poloválce D1 a D2, tzv. duanty, mezi nimiž je urychlovací mezera. Duanty jsou připojeny ke zdroji střídavého napětí o frekvenci f (okolo 20 MHz), takže v mezeře mezi deskami je střídavé elektrické pole. Nabité částice vstupují do středu urychlovací mezery z iontového zdroje. Následkem síly, kterou elektrické pole v mezeře působí na částici s nábojem q a hmotností m, je částice vtažena do jednoho z duantů (který má právě opačnou polaritu) s určitou rychlostí v1.
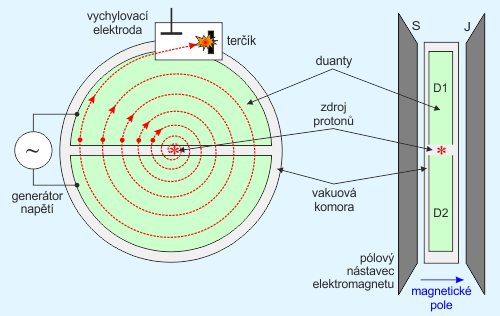
Obr. 5: Princip cyklotronu. Zdroj: [1].
Cyklotron bude při konstantní frekvenci fungovat jen do té doby, kdy hmotnost urychlované částice můžeme považovat za konstantní, tj. pouze v nerelativistické oblasti. Chceme-li použít cyklotronu k urychlování částic na energie vyšší, než cca 20 MeV, kdy se již rychlost částic značně přibližuje rychlosti světla, přestává být hmotnost částice m konstantou, ale zvyšuje se s rostoucí rychlostí. Ve stejném poměru se snižuje frekvence oběhu částic v konstantním magnetickém poli. Aby mohla být částice dále urychlována i v této relativistické oblasti, je potřeba modulovat frekvenci urychlovacího napětí tak, aby byla stále v rezonanci s frekvencí oběhu částice. Takto upravený cyklotron se „synchronizací“ se nazývá synchrocyklotron (též fázotron nebo relativistický cyklotron). Tyto přístroje se používají pro urychlování protonů na energie do cca 1 GeV. Pracují v pulzním režimu, přičemž kmitočet urychlovacího napětí na duantech je modulován a mění se cca padesátkrát za sekundu z hodnoty cca 25 MHz na začátku cyklu na cca 12 MHz na konci cyklu.


Obr. 6: Základní komponenty protonového ozařovače – nahoře: synchrocyklotron; uprostřed: rozvody urychlených hadronových svazků osazené magnetickými čočkami (Newyorské cetrum protonové terapie); dole: ozařovna s ozařovací hlavicí napojenou na gantry systém. Zdroje: IBA. LAIDEP, NYPTC.
Video 1: Základní principy protonové terapie. Zdroj: IBA.
Pro urychlování částic na velmi vysoké energie vychází v kruhovém urychlovači velký poloměr jejich orbit, takže cyklotronový způsob se spirálovým pohybem částic v ploché vakuové komoře již není prakticky použitelný. Aby vakuový prostor a elektromagnet nebyly enormně velké, je nutno použít kruhové urychlovače s pevnou kruhovou dráhou. Aby se nabitá částice urychlovala a udržela na pevné kruhové dráze o poloměru R, je potřeba, aby se s rostoucí rychlostí v(t) urychlovaných částic s časem synchronně zvyšovala jak frekvence f(t) urychlovacího napětí, tak indukce magnetického pole B(t), která již nemůže být konstantní, ale je rovněž funkcí času. Takto synchronně pracující urychlovač s pevnou kruhovou drahou se nazývá synchrotron.
Schématické znázornění jeho principu je na obr. 7. Částice jsou urychlovány ve vakuové trubici o průměru cca 3 až 8 cm (většinou eliptického průřezu), stočené do kruhu o průměru několika metrů. Trubice je obklopená velkým množstvím segmentů elektromagnetu, který budí magnetické pole udržující částice na kruhové orbitě. Synchrotron urychluje již předurychlené částice, které se do urychlovací komory vstřikují z vhodného injektoru, kterým bývá nejčastěji lineární urychlovačLINAC – zkratka používaná pro lineární urychlovače (LINear ACcelerator). Příkladem může být první urychlovací předstupeň Velkého hadronového kolideru v CERNu. V případě radioterapeutických účelů někdy užívá zkratky clinac. s energií několika desítek MeVElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K.. Spolu s magnety jsou ve vhodných místech kruhové dráhy umístěny urychlovací elektrody napájené střídavým vysokým napětím, jehož frekvence f je synchronně modulována tak, aby částice mezi elektrody přicházela v době, kdy polarita zajistí vždy další a další urychlení. Současně s frekvencí je zvyšována i magnetická indukce B. Synchrotron pracuje v pulzním režimu, kdy protony vstupující v pravidelných dávkách z injektoru do urychlovací trubice vykonají během urychlovacího cyklu, trvajícího cca tři až pět sekund, několik milionů oběhů, přičemž se urychlí na řádově stovky MeV. Magnetické pole v průběhu urychlovacího cyklu vzrůstá. Urychlovací cyklus se periodicky opakuje cca pětkrát až desetkrát za minutu.
Po skončení urychlovacího cyklu mohou být částice vyvedeny elektromagnetickým polem ven z urychlovače. Při nárazu svazku, například protonů, na terčík vzniká množství částic nejrůznějších druhů, z nichž můžeme soustavou elektrických a magnetických polí „odseparovat“ částice požadovaného druhu, fokusací je zformovat ve svazek a zamířit je na cíl. Získáváme tak sekundární svazky, například pionůPion – mezon π, částice s nulovým spinem složená z kvarků u a d. (viz dále) apod. K separaci částic se používá proměnných elektrických a magnetických polí, k fokusaci svazků pak magnetických čoček, většinou v kvadrupólovém uspořádání, kde se kříží dvě magnetická pole, jejichž gradienty postupně fokusují svazek ve vertikálním i horizontálním směru.
Synchrotron umožňuje urychlovat jak protony, tak lehké ionty za použití týchž magnetů, ve stejné fokusující soustavě. Dovoluje dosahovat požadované hustoty svazku urychlovaných částic, umožňuje měnit energii po krocích o velikosti přibližně 0,5 MeV. Je provozně jednoduchý a spolehlivý. Jeho nevýhodou je poněkud větší rozměr, zejména pro urychlování iontů, a s tím spojené vyšší pořizovací náklady.
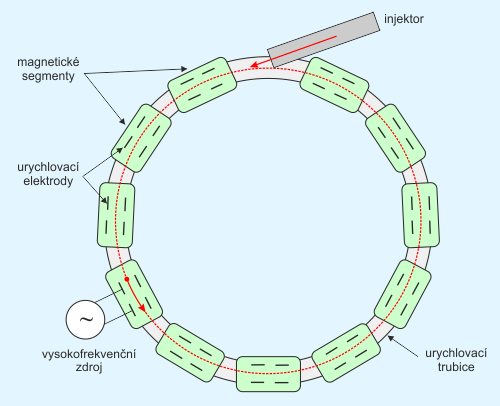
Obr. 7: Princip synchrotronu. Zdroj: [1].
Záporně nabité piony
PionyPion – mezon π, částice s nulovým spinem složená z kvarků u a d. vznikají při ostřelování jader atomů terčíku (C, Be nebo Ti) protonyProton – částice složená ze tří kvarků (duu) se spinem 1/2, hmotností 1,673×10−27 kg (938 MeV) a elektrickým nábojem +1,6×10−19 C. Proton je na běžných časových škálách stabilní, pokud se rozpadá, je poločas rozpadu větší než 1035 let. Za objevitele protonu je považován Ernest Rutherford, který v roce 1911 objevil atomové jádro při analýze rozptylu částice alfa pronikající tenkou zlatou fólií. Samotná jádra vodíku (protony) detekoval v roce 1918 při ostřelování dusíku částicemi alfa. Antiproton byl objeven v roce 1955 Emilio Segrem a Owenem Chamberlainem., jejichž energie musí být nejméně 500 MeVElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K., Hmotnost pionů je 273krát větší než elektronuElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. (asi 1/6 hmoty protonu). Dosah pionů o energii 60 až 90 MeV činí ve tkáni 12 až 23 cm. Na konci své dráhy jsou zachyceny v jádrech atomů. Ve tkáních se nejčastěji zachycují v jádrech 16O (75 %), 14N a 12C, dochází k excitaci jádra a jádro exploduje. Například na uhlíku dochází k reakci π− +12C → 2α + 1p + 3n.
Při každé jaderné reakci se uvolní cca 140 MeV (40 MeV na překonání vazebné energie jádra, 70 MeV na kinetickou energii emitovaných neutronů a 30 MeV jako kinetická energie fragmentů jader – například protonů, deuteronů, tritonů, částic α, 6Li nebo 12C, ale též elektronů a doprovodného záření γ). Dávka v Braggově maximu je 2,5krát vyšší než v plató části. Integrální dávka je tudíž menší než u jiných druhů záření. RBERBE – Relative Biological Effectiveness, relativní biologická účinnost, poměr biologické účinnosti jednoho typu ionizujícího záření k druhému, a to při stejnému množství absorbované energie. RBE je empirická hodnota, která se mění v závislosti na typu ionizujícího záření, použitých energiích, uvažovaných biologických účincích, nebo kyslíkovém efektu. se střední hodnotou 1,6 je vyšší v Braggově maximu než v plató části.
Záporně nabité piony jsou léčebně využívány například v Los Alamos, ve Standfordu, Vancouveru a ve Villigenu poblíž Curychu.
Nevýhodou pionové terapie je malý účinný průřez produkce pionů na terčíku, což vyžaduje velmi husté protonové svazky a dlouhou dobu ozařování. Je to vysoce technologicky i finančně náročný druh terapie a dlouhá ozařovací doba může být navíc stresující pro pacienta. Jedná se však o doposud nejúčinnější technologicky zvládnutý způsob léčby zhoubných nádorů za pomoci ionizujícího záření.
Aktivní skenování ložiska
Oblast předávané dávky je možné z výše uvedených principiálních důvodů vymezit u hadronových svazků mnohem lépe než u svazků fotonů či elektronů. Ztráty energie částice podél její dráhy popisuje tzv. lineární brzdná schopnost, tj. průměrná ztráta energie při průchodu látkovým prostředím na jednotku délky dráhy částice, přepočtená na jednotkovou hustotu prostředí. Přibližně lze říci, že tato veličina je nepřímo úměrná druhé mocnině rychlosti částice, těsně před jejím zastavením tedy velmi prudce narůstá. Poloha Braggova vrcholu, ve kterém dochází k předávání největší části energie, je proto v daném prostředí určena energií dopadajících částic: částice s vyšší energií pronikají tkání do větší hloubky. Jelikož se jedná o nabité částice, je jim možné pomocí urychlovačů udělit takovou energii, která odpovídá potřebné hloubce průniku prostředím (tkání).
Obr. 8: Změna polohy Braggova maxima ve vodě se změnou
energie hadronů a sumární hloubková dávka
Pomocí magnetů lze dále měnit směr svazku těchto částic, kolimovat svazek atd. Cílový objem mívá rozměry i několika centimetrů a je třeba ho celý pokrýt homogenně stejnou dávkou záření. Braggův pík má však rozměr jen několika milimetrů, proto je ho třeba rozšířit do rozměru odpovídajícímu velikosti nádoru.
Principiálně nejvýhodnější postup představuje metoda aktivního skenování nádorového ložiska. Při této metodě je objem ložiska meandrovitým způsobem skenován úzkým tužkovým svazkem částic v několika rovnoběžných rovinách. S ozařováním se začíná v rovině nejvzdálenější od povrchu těla pacienta. Po ozáření jedné roviny se změní energie svazku částic a ozařuje se další rovina, bližší k povrchu pacienta. Tloušťka jednotlivých rovin je dána v podstatě velikostí příčného průřezu nemodifikovaného, tedy úzkého Braggova vrcholu. Při ozařování mělčí vrstvy je vždy započtena dávka, která již byla tkáni předána při průchodu svazku částic při ozařování hlouběji uložených vrstev. Postupně je tak ozářen celý cílový objem. Lze dosáhnout značné homogenity rozložení absorbované dávky. Princip této metody ilustruje obrázek 9.
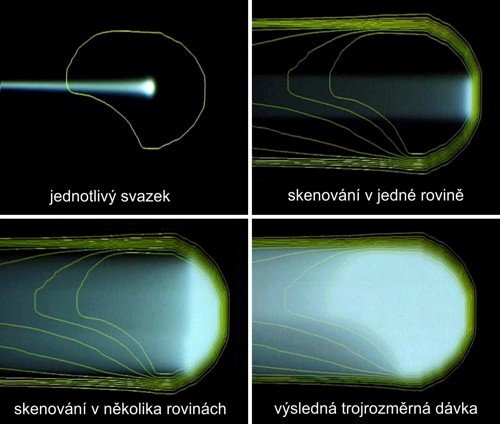
Obr. 9: Princip aktivního skenování cílového objemu tužkovým protonovým svazkem
Video 2: Klip společnosti Varian, v němž je mj. patrný princip aktivního skenování
Při použití aktivní techniky modulace svazku, která umožňuje přizpůsobit i přední a boční okraj ozařované oblasti tvaru nádorového ložiska, nejsou tkáně ležící za cílovou oblastí vystaveny prakticky žádné dávce a poměrně malá je i zátěž tkání před touto oblastí. Dalšího výrazného snížení zátěže okolních tkání lze podobně jako v konvenční radioterapii dosáhnout kombinací ozáření z více polí.
Základní klinické požadavky
Urychlovač musí především umožnit, aby částicím byla udělena dostatečně vysoká energie, která zajistí potřebný dolet částic ve tkáních a zasažení nádorového ložiska v libovolné hloubce pod povrchem těla. Pro protony činí potřebná maximální energie 220 až 250 MeV, v případě lehkých iontů je to až dvojnásobek součinu této hodnoty a počtu nukleonů, z nichž daný ion (atomové jádro) sestává. Například pro ionty C6+ je požadovaná maximální energie 400 MeV/nukleon. Zařízení musí dále umožnit volit energii urychlovaných částic v dostatečně širokém oboru, který odpovídá potřebnému rozsahu hloubek ozařovaných nádorů (přibližně 2 až 25 cm). Pro protony činí toto energetické rozmezí přibližně 60 až 220 MeV, pro ionty uhlíku 120 až 400 MeV na nukleon. Aby bylo možné využít metodu aktivního skenování, musí urychlovač provádět tyto změny energie (tedy posun hloubky Braggova maxima) po dostatečně malých krocích, menších než 0,5 MeV.
Přesnost nastavení energie by měla mít hodnotu 0,1 %. Urychlovač musí poskytovat dostatečně intenzivní svazek hadronů, který by při frakcionovaném režimu ozařování umožnil předat do nádoru dávku 2 GyGray – Gy, jednotka absorbované dávky záření, energie ionizujícího záření absorbovaného v 1 kg látky. 1 Gy = 1 J/kg. Vyjadřuje pouze energii absorbovaného ionizujícího záření, nikoli jeho účinky na danou látku. Menší jednotkou je centigray (cGy), setina graye./frakci za dobu přibližně 2 až 2,5 min. Činí-li maximální velikost ozařovaného objemu 2 litry při aktivním skenování, je zapotřebí urychlovat přibližně 1010 protonů nebo 108 iontů C6+ za sekundu, aby ozařovací doby nebyly příliš dlouhé.
Aktivní skenování ložiska představuje z terapeutického hlediska nejvhodnější řešení, neboť dovoluje nejlépe přizpůsobit oblast předávané energie tvaru cílové oblasti. Tato metoda ale klade vyšší nároky na kvalitu svazku urychlovaných částic.
Rozvod hadronových svazků – gantry
Podobně jako v konvenční radioterapii je i při použití hadronovýchHadrony – částice složené z kvarků, které interagují silnou a slabou jadernou interakcí, pokud jsou nabité, také elektromagneticky. Dělíme je na mezony složené z kvarku a antikvarku a baryony složené ze tří kvarků různých barev. Název je odvozeninou z řeckého hadros (silný, těžký). K nejznámějším mezonům patří piony, k nejznámějším baryonům neutron a proton. Hmotnosti hadronů převyšují hmotnost elektronů o několik řádů. Jejich interakce s látkovým prostředím se výrazně liší jak od elektronů, tak i od fotonů. svazků v mnohých případech výhodné ozařovat nádorovou oblast z více směrů. Proto je třeba, aby alespoň některé ozařovací místnosti (ozařovny) byly vybaveny portálovým otočným rozvodem svazku (tzv. gantry systémemGantry systém – část ozařovače, která zajišťuje rotaci generovaného svazku záření okolo pacienta.) umožňujícím otáčet svazek částic o 360° kolem pacienta a ozařovat nádorové ložisko z různých úhlů. Celé zařízení musí zajišťovat vysokou provozní spolehlivost, snadnou obsluhu a spolehlivou reprodukci ozařovacích podmínek. Významné jsou také jeho rozměry a zejména pořizovací i provozní náklady.
Částice s potřebnou energií jsou po extrakci z urychlovače přiváděny transportní trasou do ozařoven. Jeden urychlovač může být využit pro postupné ozařování ve třech až pěti ozařovnách.
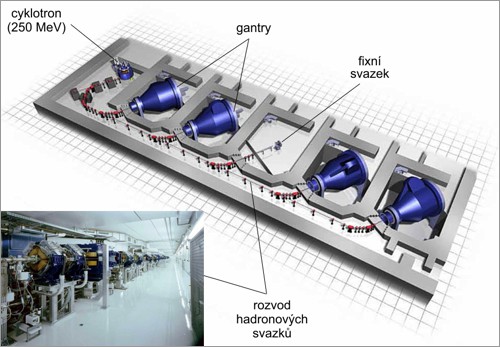
Obr. 10: Příklad uspořádání pracoviště protonové radioterapie s cyklotronem.
Zdroj: Rinecker Proton Therapy Center (RPTC), Mnichov.
Video 3: Základní principy protonové terapie ve zkratce – od cyklotronu k
pacientovi.
Zdroj: Varian, University College London Hospitals, NHS
Foundation Trust
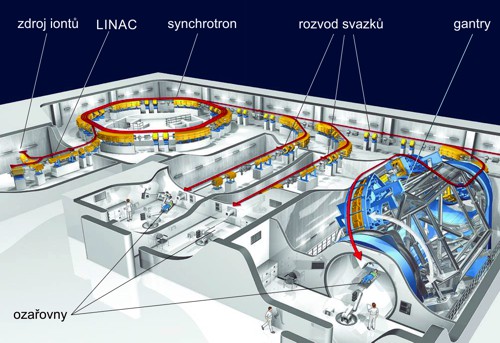
Obr. 11: Schéma pracoviště hadronové radioterapie se synchrotronem.
Zdroj: Heidelberger Ionenstrahl-Therapiezentrum (HIT).

Obr. 12: Gantry systém hadronového ozařovače s mohutnými bending magnetyBending magnet – magnet sloužící k zakřivení dráhy urychleného elektronového svazku o předem definovaný úhel (napříklsd o 90°, resp. 270°) před jeho výstupem z evakuované urychlovací trubice.. Hadronový gantry systémGantry systém – část ozařovače, která zajišťuje rotaci generovaného svazku záření okolo pacienta. je technicky velmi náročným zařízením a již v případě protonů je jeho pořizovací cena takřka srovnatelná s cenou samotného synchrotronu.
Video 4: Model pracoviště hadronové radioterapie se synchrotronem vyvinutý
studiem DEMCON Nymus 3D pro potřeby CERN
Monitorování a dozimetrie hadronových terapeutických svazků
Pro optimální využití možností hadronové radioterapie je nutné, aby dávka, která je pacientovi skutečně aplikována, souhlasila s dávkou předepsanou podle příslušného ozařovacího plánu. V průběhu ozařovacího procesu je proto nezbytné jak pečlivé monitorování kvality svazku, tedy sledování jeho polohy, profilu, energie, homogenity a dalších parametrů, tak také měření dávky předávané pacientovi v reálném čase, aby bylo možné ukončit ozařování ihned po dosažení předepsané dávky. Pro monitorování a dozimetrii svazku jsou používány zejména ionizační komoryIonizační komora – plynový detektor pracující v tzv. oblasti nasyceného proudu, tj. v intervalu velikostí připojeného elektrického napětí, kdy počet sebraných nosičů náboje odpovídá počtu těchto nosičů náboje uvolněných ionizujícím zářením (v detektoru tedy nedochází k plynovému zesílení, ani ohmickému zeslabení jeho účinnosti). a polovodičové či termoluminiscenční dozimetryTermoluminiscenční dozimetrie – TLD, integrující dozimetrická metoda využívající tzv. termoluminiscenční jev v některých materiálech, jako je například fluorid lithný, zubní sklovina apod. Při něm jsou ionizujícím zářením vybuzeny elektrony z valenčního do vodivostního pásu a během deexcitace mohou být zachyceny v kvantových pastech ležících nad energií valenčního pásu. Množství elektronů zachycených v pastech je v určitém rozmezí hodnot úměrné absorbované dávce záření. Elektrony mohou zachycené v pastech setrvat i řadu týdnů. Během rychlého zahřátí na teplotu v řádu několika set °C jsou elektrony z pastí prudce vypuzeny a při návratu do valenčního pásu vyzáří foton ve viditelné oblasti spektra. Množství světla emitovaného zahřívaným TLD je tedy úměrné absorbované dávce. Fotonásobičem je světlo zesíleno, převedeno na elektrický proud a celkový sebraný náboj je následně přepočten na absorbovanou dávku prostřednictvím kalibrační přímky..
Biologický efekt hadronové terapie
Nejvyšší poměr dávky v Braggově vrcholu (maximu) k dávce v oblasti plató je u záporně nabitých pionůPion – mezon π, částice s nulovým spinem složená z kvarků u a d. a dále u protonůProton – částice složená ze tří kvarků (duu) se spinem 1/2, hmotností 1,673×10−27 kg (938 MeV) a elektrickým nábojem +1,6×10−19 C. Proton je na běžných časových škálách stabilní, pokud se rozpadá, je poločas rozpadu větší než 1035 let. Za objevitele protonu je považován Ernest Rutherford, který v roce 1911 objevil atomové jádro při analýze rozptylu částice alfa pronikající tenkou zlatou fólií. Samotná jádra vodíku (protony) detekoval v roce 1918 při ostřelování dusíku částicemi alfa. Antiproton byl objeven v roce 1955 Emilio Segrem a Owenem Chamberlainem.. Nižší je u alfa částicAlfa částice – jádro helia, vázaný stav dvou protonů a dvou neutronů. Přirozenou cestou vzniká při alfa rozpadu. Vzhledem k velké vazebné energii jde o vysoce stabilní částici. a u ostatních těžkých částic. Všechny tyto těžké urychlené částice vykazují v oblasti Braggova vrcholu vysoký lineární přenos energie (LETLET – Linear Energy Tranfer, lineární přenos energie, fyzikální veličina popisující hustotu přenosu energie z částic ionizujícího záření na látkové prostředí: LET = dE/dl.), a tím vysokou relativní biologickou účinnost (RBERBE – Relative Biological Effectiveness, relativní biologická účinnost, poměr biologické účinnosti jednoho typu ionizujícího záření k druhému, a to při stejnému množství absorbované energie. RBE je empirická hodnota, která se mění v závislosti na typu ionizujícího záření, použitých energiích, uvažovaných biologických účincích, nebo kyslíkovém efektu.). Buňky v oblasti plató mají tedy větší možnost reparace ze subletálního poškození. Vysoká hodnota RBERBE – Relative Biological Effectiveness, relativní biologická účinnost, poměr biologické účinnosti jednoho typu ionizujícího záření k druhému, a to při stejnému množství absorbované energie. RBE je empirická hodnota, která se mění v závislosti na typu ionizujícího záření, použitých energiích, uvažovaných biologických účincích, nebo kyslíkovém efektu. v cílovém objemu a nižší v oblasti plató znamená vyšší TGFTGF – Therapeutic Gain Factor, faktor terapeutického zisku. Poměr zlepšení míry lokální kontroly nad nádorovým ložiskem a míry radiačního poškození okolní zdravé tkáně. (Therapeutic Gain Factor) – faktor terapeutického zisku, důležitý pro optimalizaci terapie.
Hustě ionizující druhy záření, mající vysoký lineární přenos energie (neutrony, protony, ionty, piony) a na rozdíl od fotonového a elektronového záření jsou charakterizovány biologickými efekty:
- snížením OER (Oxygen Effect Ratio), tj. zesilujícího efektu kyslíkuKyslíkový efekt – Oxygen Enhancement Ratio, OER. Jedním z významných radiobiologických faktorů je tzv. nepřímý účinek ionizujícího záření spočívající v radiační indukci kyslíkových radikálů, které následně napadají DNA a ničí živé buňky. Tento tzv. zesilující efekt kyslíku (zkráceně kyslíkový efekt) má často rozhodující vliv na úspěšnost protinádorové léčby ionizujícím zářením. Nádorové buňky však naneštěstí bývají často hypoxické, neboť nemají vybudované dostatečně robustní cévní zásobení. Nepřímý účinek ionizujícího záření je tak zasahuje paradoxně méně než okolní zdravé buňky. Po iradiaci se cévní řečiště zásobující nádor ještě více tromboticky uzavírá, což vede k větší hypoxii buněk nádoru a zpomalení jejich růstu, současně však i vyšší radiorezistenci.. V praxi to znamená, že biologický účinek záření se nezvyšuje zvýšeným zásobením kyslíkem a že letální efektLetální dávka – LD, Letal Dose. Dávka záření, která je považována (zpravidla minimálně v 50 % případů) za smrtelnou. záření na euoxické a hypoxické buňky je prakticky stejný;
- snížením reparace ze subletálního poškození buněk, protože většina zásahů je letálních (na křivce přežití mizí raménko);
- vzhledem k a) a b) je vyšší relativní biologická účinnostRBE – Relative Biological Effectiveness, relativní biologická účinnost, poměr biologické účinnosti jednoho typu ionizujícího záření k druhému, a to při stejnému množství absorbované energie. RBE je empirická hodnota, která se mění v závislosti na typu ionizujícího záření, použitých energiích, uvažovaných biologických účincích, nebo kyslíkovém efektu..
Porovnání výsledků fotonové a hadronové terapie
Obrázek 13 umožňuje srovnání nejmodernější dostupné metody pro ozařování fotonovými svazky, kterou je metoda intenzitně modulované radioterapie (IMRTIMRT – Intensity Modulated Radiotherapy, radioterapie s modulovanou intenzitou svazku.), a protonové terapie s využitím aktivního skenování (IMPTIMPT – Intensity Modulated Proton Therapy, protonová terapie s modulovanou intenzitou svazku.). Jedná se o nádor nosohltanu, sekundární cílovou oblastí jsou napadené lymfatické uzliny (na obrázcích ohraničeny žlutě). Kritickými orgány jsou mozkový kmen a příušní žlázy (vymezeny červeně). Metoda IMRT dovoluje významně šetřit tyto citlivé orgány, viz bulletin 24/2021.
Protonová terapie nabízí ještě dokonalejší konformaci této oblasti (viz obr. 13), a to i s menším počtem ozařovacích polí. Jak mozkový kmen, tak příušní žlázy jsou maximálně šetřeny. Nedochází také k celkovému ozáření mozku jako při IMRT (kdy je mozek zatížen 30 % až 60 % ložiskové dávky, viz stupnice v pravé části výsledného ozařovacího plánu). Zátěž okolních zdravých tkání je tak výrazně snížena.
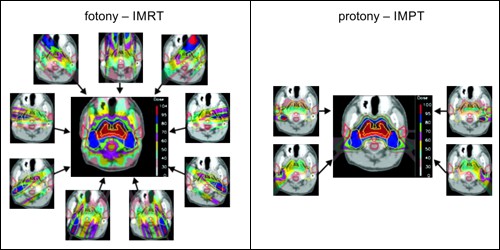
Obr. 13: Výhody hadronové IMPTIMPT – Intensity Modulated Proton Therapy, protonová terapie s modulovanou intenzitou svazku. terapie v porovnání s fotonovou IMRTIMRT – Intensity Modulated Radiotherapy, radioterapie s modulovanou intenzitou svazku. terapií. Cílovými oblastmi jsou nosohltan a mozkomíšní uzliny (žlutě), kritickými orgány jsou mozkomíšní kmen a příušní žlázy (červeně).
Základní výhodou hadronové radioterapie je možnost umístit oblast maximální předávané energie do nádorového ložiska a přesněji ji přizpůsobit jeho tvaru. Díky tomu lze výrazně zvýšit ložiskovou dávku a tím i pravděpodobnost lokální kontroly nádoru (jeho eradikace), při současném snížení zátěže okolních tkání a rizika vzniku komplikací. Podobně jako v konvenční radioterapii se i zde využívá ozařování z více polí a frakcionované ozařování. Dokumentuje to obrázek 14 na příkladu karcinomu prostaty, jehož léčba představuje jednu z důležitých indikací hadronové terapie. Pro porovnání je zde ukázáno i rozložení dávek při použití konvenčního záření X ze stejných ozařovacích polí.
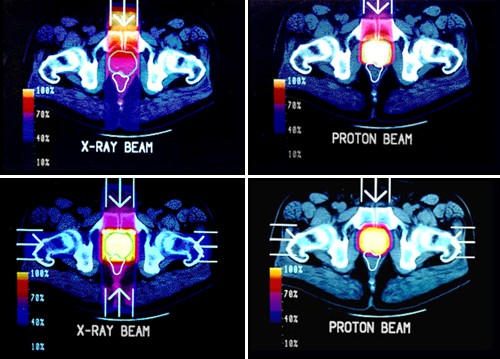
Obr. 14: Karcinom prostaty. Srovnání konvenčního záření X (nalevo) a protonových
svazků (napravo) při ozařování jedním a čtyřmi, resp. třemi poli.
Ekonomické hledisko
Cena kompletního radiačně onkologického pracoviště s protonovou terapií, které obsahuje několik gantry systémů, se pohybuje v rozmezí dvou (synchrocyklotron) až čtyř (synchrotron) miliard českých korun. Ozařování pomocí iontových svazků je z technického hlediska náročnější a finanční náklady příslušného zařízení jsou poněkud vyšší. Centrum musí navazovat na stávající standardně vybavená radiačně onkologická pracoviště. V případě, že by toto centrum bylo budováno zcela samostatně bez návaznosti na jiná lékařská zařízení, je nutno počítat s cenou úměrně vyšší.
Shrnutí
V případě protonových svazků byl již získán dostatek klinických zkušeností, svazky lehkých iontů představují metodu, která je dosud spíše ve výzkumném stadiu. Výsledky dosahované pomocí léčby hadronovými svazky jsou pro řadu typů a lokalizací nádorových onemocnění výrazně lepší než konvenční ozařování. Tento způsob terapie je úspěšný v případech, kdy nelze použít chirurgický postup a léčba konvenčním zářením selhává. Hadronová terapie představuje léčebnou metodu, která umožňuje zvýšit celkovou úspěšnost léčby nádorových onemocnění až o 10 %. Na základě zkušeností získaných ve světě lze stanovit, pro jaké diagnózy či lokalizace nádorových onemocnění jsou svazky hadronů prakticky nepostradatelné, tj. kdy je pravděpodobnost úspěšného zvládnutí choroby bez vzniku komplikací při použití ostatních léčebných metod velmi malá. Do této skupiny patří například některé nádory očí, páteře a jejího nejbližšího okolí, mozku, hypofýzy nebo obličejové části hlavy. Jako příklad výhodného použití protonové terapie lze uvést léčbu nádoru base lební typu chordoma, kdy při terapii pomocí konvenčního záření činí pětileté přežití 40 %, zatímco při použití protonové terapie 82 %.
Hadronová terapie – neutronová kolizní terapie
Nad 20 MeVElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K. mají neutrony dostatečnou energii k dezintegraci jader atomů přímou kolizí. Pod 20 MeV je hlavní reakcí elastický rozptyl, který vede ke ztrátě energie neutronů až na termální hladinu. Rychlé neutronyNeutron – částice složená ze tří kvarků (ddu) se spinem 1/2, hmotností 1,675×10−27 kg (940 MeV) a nulovým elektrickým nábojem. Volné neutrony jsou nestabilní se střední dobou života 886 s (15 minut) a poločasem rozpadu 10 minut. V roce 1930 Walther Bothe a Herbert Becke ostřelovali lehké prvky alfa částicemi a objevili nový druh pronikavého záření. V roce 1932 zjistil James Chadwick, že je toto záření složeno z neutrálních částic přibližné velikosti protonu a objevil tak neutron. vznikají při dopadu urychlených nabitých hadronůHadrony – částice složené z kvarků, které interagují silnou a slabou jadernou interakcí, pokud jsou nabité, také elektromagneticky. Dělíme je na mezony složené z kvarku a antikvarku a baryony složené ze tří kvarků různých barev. Název je odvozeninou z řeckého hadros (silný, těžký). K nejznámějším mezonům patří piony, k nejznámějším baryonům neutron a proton. Hmotnosti hadronů převyšují hmotnost elektronů o několik řádů. Jejich interakce s látkovým prostředím se výrazně liší jak od elektronů, tak i od fotonů. (nejčastěji se používají urychlené deuteronyDeuteron – jádro těžkého vodíku, obsahuje jeden proton a jeden neutron. V průměru na Zemi připadá na 7 000 atomů normálního vodíku jeden atom deuteria. Jde o stabilní izotop vodíku.) na terčík o nízkém atomovém čísle, jako je 9BeBerylium – nejlehčí prvek ze skupiny kovů alkalických zemin, tvrdý, šedý kov o značně vysoké teplotě tání. Vede špatně elektrický proud a teplo. Velmi dobře propouští radioaktivní záření. Jeho soli jsou mimořádně toxické. Berylium bylo objeveno roku 1798 Louisem Vauguelinem jako součást minerálu berylu a smaragdů., či 3TTritium – velmi těžký vodík, v jádře má jeden proton a dva neutrony. Jde o nestabilní jádro s poločasem rozpadu 12,32 let.. Jako urychlovač se používá deuteronový cyklotronCyklotron – slouží k urychlování nabitých částic, které jsou vedeny na kruhové dráze pomocí magnetického pole. Vlastní urychlování probíhá vysokofrekvenčním elektrickým polem v mezeře mezi elektrodami (duanty). Opakovaným průchodem dochází k urychlování. Prvního předchůdce cyklotronu postavil roku 1929 až 1931 americký fyzik Ernest Lawrence z University of California..
Deuteronový cyklotron
Deuteronový cyklotron s beryliovým terčíkem je klinicky vyzkoušený přístroj s vysokým dávkovým příkonem. Čím větší je energie urychlených deuteronů, tím větší je energie generovaných neutronů a tím se dosáhne větší hloubky maxima dávky. Například při energii deuteronů 33 MeV se získají neutrony o energii 14 MeV.
Neutrony nejsou při procházení hmotou ovlivňovány elektrony z atomového obalu, neboť nenesou elektrický náboj. Z důvodu splnění zákonů zachování energie a hybnosti interagují zejména s jádry podobné hmotnosti, jakou mají samy (například s vodíkem). Proto jsou neutrony dobře absorbovány vodou. Situaci si lze názorně představit na příkladu pružného rázu koulí. Budeme-li posílat kupříkladu pingpongové míčky (neutrony) proti bowlingovým koulím v klidu (těžká jádra), velikost rychlosti míčků ani koulí se nezmění (neutrony se budou pouze odrážet a rozptylovat, ale nebudou předávat žádnou energii látce). Když ale necháme srážet pingpongové míčky s plastovými kuličkami srovnatelné hmotnosti, které jsou před srážkou opět v klidu (lehká jádra), přejde takřka veškerá energie pingpongových míčků na plastové kuličky (dojde k předání energie látce, a tedy k ionizaci). Zatímco míčky se prakticky zastaví, kuličky získají jejich rychlost.
V měkkých tkáních se 85 až 95 % energie neutronů přeměňuje při elastických srážkách s vodíkovými jádry, které neutrony vyrážejí z molekulárních vazeb jako protony. Ty jsou elektricky nabité, a tudíž schopné přímé ionizace látky. Neutrony jsou tedy, podobně jako například fotony a jiné nenabité částice, tzv. nepřímo ionizujícími částicemi.
Neutrony vyletují z beryliového terčíku, který je bombardován rychlými deuterony z cyklotronu. Ochranný plášť proti neutronovému záření tvoří z pravidla vodní nádrže, parafínové nebo bórové stínění.

Obr. 15: Ozařovací hlavice deuteronového cyklotronu
Se stoupající energií urychlených deuteronů se zvyšuje energie neutronů, a tím i hloubka maxima dávky, která se posunuje pod povrch ozařovaného objemu (skin-sparing-effectSkin-sparing-effect – důsledek build-up efektu, spočívající ve skutečnosti, že čím tvrdší nepřímo ionizující záření dopadá na pacienta, tím nižší je absorbovaná dávka v kůži. – efekt šetření kůže na povrchu ozařovaného objemu). Cyklotron Be(d,n) s výstupní energií 16 MeV má „build-upBuild-up effect – fyzikální jev charakteristický pro ozařování nepřímo ionizujícím zářením. V blízkosti povrchu, kterým vstupuje fotonové záření do látky, je vysoká pravděpodobnost, že část energie předané z fotonů na nabité částice (charakterizované veličinou kerma) opět unikne z látky pryč ve formě brzdného, charakteristického, rozptýleného a anihilačního záření. S narůstající hloubkou roste pravděpodobnost, že i tato záření stihnou v látce zainteragovat a předat jí tak svoji energii. Veličina absorbovaná dávka představuje energii, která byla skutečně sdělena (předána) elementu látky, vydělenou hmotností tohoto elementu. Blízko povrchu látky je proto dávka mnohem menší než kerma, a hodnoty obou veličin se k sobě přiblíží až v určité hloubce (hloubce maxima dávky), která je funkcí energie dopadajících fotonů a materiálu látky." (zónu narůstání elektronové rovnováhy) jako záření 137Cs, cyklotron Be(d,n) s energií 30 MeV jako záření 60Co, tj. maximum hloubkové dávky v 0,5 cm pod povrchem. Se stoupající energií se podobně jako u fotonů zvyšuje procentuální hloubková dávka.
U protonových cyklotronů je procentuální dávka rychlých neutronů (%Dn) vyšší než u deuteronových: %Dn 30 MeV Be(d,n) = 26 MeV Be(p,n) (po odfiltrování měkké složky polyetylenovým filtrem). Dávkový příkon je pětkrát až šestkrát větší u deuteronových cyklotronů než u protonových. Protonový cyklotron s beryliovým terčíkem dává tedy lepší hloubkové dávky, avšak má nízký dávkový příkon. Aby se zvýšil dávkový příkonu u protonových cyklotronů, musí se zvýšit zatížení terčíku, což omezuje jeho životnost.
Neutronové záření je provázeno složkou záření γ. Podíl Dγ : Dn při průchodu vzduchem se s narůstající vzdáleností od terčíku snižuje, ve vodním prostředí naopak stoupá se zvětšující se hloubkou. Všechny hydrogenní materiály, které jsou vloženy do svazku neutronového záření, jako klínové nebo kompenzační filtry, musí být na ploše směřující k ozařovanému subjektu potaženy 0,5 mm vrstvou olova, která zachytí toto doprovodné záření gama.
Neutronová kolizní terapie se prováděla asi ve dvaceti centrech v deseti zemích, postupem času však byla vytlačována jinými ozařovacími metodami. Využití v medicínské aplikaci našla zejména při terapii nádorů slinných žláz a tumorů prostaty neutronovým paprskem o energii 50 až 70 MeV. V současné době je dostupná v Německu, Rusku a ve Spojených státech.
Hadronová terapie – bór neutronová záchytová terapie
Dalším zajímavým nekonvenčním postupem pro zvýšení selektivity ozáření nádorového ložiska je tzv. bór neutronová záchytová terapie (BNCT – Boron Neutron Capture Therapy). Při tomto terapeutickém postupu se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Používá se bór 10B, jehož speciálně vyvinuté sloučeniny (BSH – merkaptododekarborát, či BPA– dihydroxyboralfenylalanin) se do zdravé mozkové tkáně dostávají jen v nepatrné míře, avšak v buňkách nádorové tkáně, která má porušenou hematoencefalickou bariéruHematoencefalická bariéra – souvislá vrstva endotelu mozkových kapilár, bazální membrána a z mozkové strany vrstva astrocytů. Endotel mozkových kapilár se odlišuje od endotelu v jiných tkáních tím, že je bez fenestrací (pórů) a endotelové buňky jsou spojeny těsnými kontakty (tight junctions). K bazální membráně jsou připevněny výběžky astrocytů společně s mikrogliálními buňkami. Z krve do mozku snadno prostupuje voda a látky dobře rozpustné v lipidech (např. etanol, nikotin, O2, CO2, N2O). Nezbytné hydrofilní látky (glukóza, neutrální aminokyseliny) musí být do mozku aktivně transportovány pomocí specifických transportních systémů spotřebovávajících energii. Díky tomu může být výměna látek mezi krví a mozkovou tkání regulována. , se selektivně vychytávají.
Takto připravené nádorové ložisko se pak ozáří svazkem epitermálních neutronůEpitermální neutrony – neutrony s energií ležící mezi termálními (neutrony s energií nižší než 1 eV) a rychlými (neutrony s energií vyšší než 100 keV). (s energiemi cca 1 eV až 20 keV), které se při průchodu tkání dále zpomalují (moderují) na tepelnou energii a jsou pak zachycovány v jádrech bóru, přičemž dochází reakcemi (n, α): 1n + 10B → 7Li + 4He k rozpadu jádra bóru a emisi jader hélia (tj. alfa částic) a lithia. Vzniklé alfa částice a lithiová jádra odnášející značnou energii uvolněnou v reakci, mají v tkáni velmi malý dosah, cca 10 µm od místa reakce, takže ionizační energie je předávána prakticky pouze příslušným nádorovým buňkám, které mohou být likvidovány bez radiačního poškození okolních tkání.
Popsaná metoda byla experimentálně testována u mozkových nádorů glioblastoma multiformeGlioblastoma multiforme – agresivní inoperabilní mozkový nádor prorůstající mozkovou tkání jako jemná pavučina. Prozatím končí toto onemocnění ve 100 % případů smrtí pacienta. Neutronová záchytová terapie však dokáže život pacientů zasažených tímto typem nádoru prodloužit a zkvalitnit. a též mozkových metastáz kožního melanoblastomu) s poměrně slibnými výsledky. V České republice se neutronová záchytová terapie prováděla na přelomu tisíciletí v Ústavu jaderného výzkumu v Řeži u Prahy na experimentálním jaderném reaktoru LVR-15, který vidíme na obrázku 16.

Obr. 16: Vlevo jaderný reaktor LVR-15 v Centru výzkumu Řež. Vpravo pohled do aktivní zóny reaktoru LVR-15, kde právě probíhá štěpná řetězová reakce. Dobře je patrno Čerenkovovo zářeníČerenkovovo záření – kužel elektromagnetického záření v podobě rázové vlny, který vzniká za nabitou částicí pohybující se nadsvětelnou rychlostí v daném prostředí., které je viditelné pouhým okem v modrofialové oblasti spektra. Vyzařují jej nabité částice, které se v daném prostřední pohybují rychlostí vyšší než světlo. Zdroj: Centrum Výzkumu Řež, s. r. o.
V aktivní zóně reaktoru probíhá exotermická štěpná jaderná reakce uranu 235
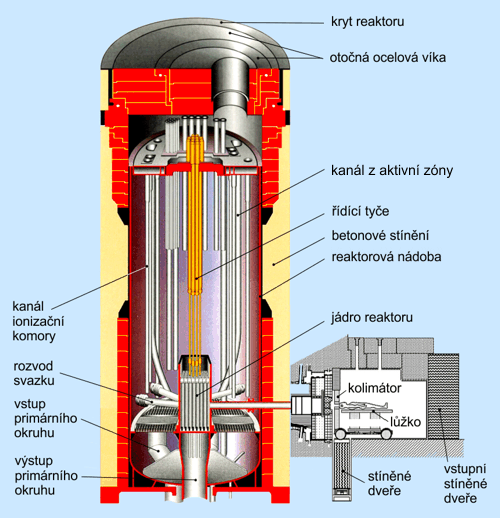
Obr. 17: Schéma vyvedení svazku epitermálních neutronů z aktivní zóny
reaktoru LVR-15 do radioterapeutické ozařovny
Na obr. 17 vidíme, kterak jsou tyto neutrony vyvedeny z aktivní zóny do ozařovny, kde je prováděna neutronová záchytová terapie mozkového nádoru glioblastoma multiformeGlioblastoma multiforme – agresivní inoperabilní mozkový nádor prorůstající mozkovou tkání jako jemná pavučina. Prozatím končí toto onemocnění ve 100 % případů smrtí pacienta. Neutronová záchytová terapie však dokáže život pacientů zasažených tímto typem nádoru prodloužit a zkvalitnit.. Neutronový svazek je veden kanálem dlouhým 4 metry z aktivní zóny a je filtrován pomocí vrstvy Al – AlF3, v níž neutrony odevzdají většinu své kinetické energie. Filtrace navyšuje zastoupení epitermálníchEpitermální neutrony – neutrony s energií ležící mezi termálními (neutrony s energií nižší než 1 eV) a rychlými (neutrony s energií vyšší než 100 keV). a tepelných neutronůTermální neutrony – neutrony s energií nižší než jeden elektronvolt, a tím správně moderuje svazek, aby splnil požadavky pro BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony.. Jeho vlastnosti jsou monitorovány prostřednictvím neutronové dozimetrie (Si detektory, aktivační detektory…). Poté se neutrony kolimují do svazku soustavou kolimátorů. Termální a epitermální neutrony se chovají podobně jako ohřátý plyn a odrážejí se od stěn kolimátoru zhotoveného z těžkých prvků o vysoké hustotě atomů. To je výrazný rozdíl ve srovnání s rychlými neutrony, které naopak látkami s velkým protonovým číslem nerušeně prostupují, jak plyne ze zákona zachování energie a hybnosti. Jako materiál vodícího potrubí tepelných neutronů se obvykle používá olovo, bismut nebo nikl.

Obr. 18: Vlevo pohled z vrchu na ozařovnu pro bór-neutronovou záchytovou terapii v Centru výzkumu Řež. Menší místnost napravo je ovladovna, odkud lékaři společně s fyziky monitorují celý průběh ozařování pacienta. Na obrázku vpravo vidíme interiér ozařovny s ozařovacím lůžkem a ústím kanálu neutronového svazku.
Princip metody
Ideální léčba rakoviny je ta, která selektivně ničí všechny rakovinné buňky bez současného poškození zdravých buněk okolní tkáně. Moderní léčebné metody (chirurgie, chemoterapie či radioterapie) jsou sice úspěšné při léčbě některých druhů rakoviny, avšak existuje spousta výjimek (například pro nádory typu glioblastoma či melanoma, metastazující nádory hlavy a krku). Právě pro tyto typy je terapie BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony. úspěšnější než ostatní metody.
Neutronová záchytová terapie je v současné době jednou z nejvíce rozvíjených metod léčby rakoviny ve světě (Japonsko, Evropa, USA, Čína, Tchaj-wan, Argentina). Její princip byl popsán již v roce 1936 (Gordon L. Locher, Franklinův institut v Pennsylvánii), první experimenty na zvířatech započaly o dva roky později a první klinické studie na lidech v roce 1950 na Brookhaven Graphite Research Reactor (BGRR) ve státě New York.
Princip je velmi jednoduchý a elegantní. Do krevního řečiště pacienta je implantován tzv. nosič – chemická látka obsahující (pokud možno stabilní) izotop s vysokým účinným průřezem pro záchyt pomalých neutronů schopná se navázat (ideálně pouze) na rakovinné buňky. Následně se tkáň ozáří pomalými neutrony, dojde k jejich záchytu, následnému rozpadu jádra izotopu a uvolnění energie. Tato energie v podobě kinetické energie produktů rozpadu způsobí zlomy DNADNA – Deoxyribonucleic acid, deoxyribonukleová kyselina. Jde o nukleovou kyselinu, jejíž cukernou složkou je 2'-deoxyribóza. Báze jsou tvořeny především čtveřicí adenin, thymin, guanin a cytosin; vzájemně komplementární jsou nukleotidy s adeninem a thyminem, a nukleotidy s cytosinem a guaninem. DNA vytváří dvoušroubovici z navzájem komplementárních opačně orientovaných řetězců, pracovního a paměťového. Její hlavní funkcí je uchovávání genetické informace. v buňce, a tím dojde k jejímu usmrcení (buňka ztratí schopnost se dále dělit). Protože produkty reakce mají vysoký LETLET – Linear Energy Tranfer, lineární přenos energie, fyzikální veličina popisující hustotu přenosu energie z částic ionizujícího záření na látkové prostředí: LET = dE/dl., deponují veškerou svoji energii v buňce obsahující příslušný izotop. Okolní buňky zůstanou tedy „ušetřeny“.
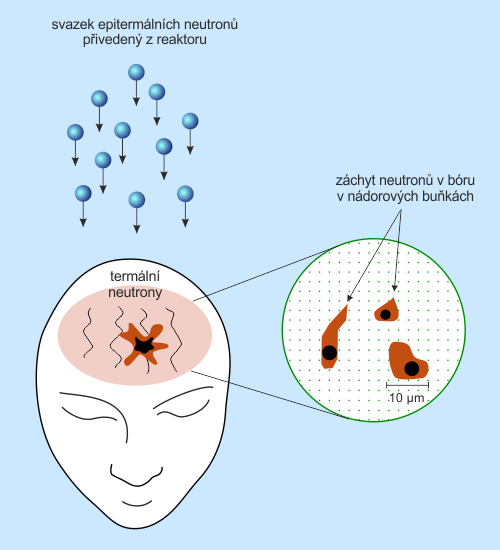
Obr. 19: Schéma biologického principu bór-neutronové záchytové terapie
V následující tabulce je přehled uvažovaných izotopů pro neutronovou záchytovou terapii. Použití je ovšem omezeno tím, zda se dá prvek zabudovat do organické sloučeniny, která nebude pro organizmus toxická a kterou budou rakovinné buňky cíleně vychytávat.
| nuklid | ? (barnbarn – jednotka plochy (10−28 m2), ve které se měří účinný průřez srážek. Inverzní femtobarn (fb−1) je mírou počtu srážek na femtobarn cílového účinného průřezu, jde o jednotku tzv. luminosity.) | nuklid | σ (barnbarn – jednotka plochy (10−28 m2), ve které se měří účinný průřez srážek. Inverzní femtobarn (fb−1) je mírou počtu srážek na femtobarn cílového účinného průřezu, jde o jednotku tzv. luminosity.) |
|---|---|---|---|
| 3He | 5 500 | 113Cd | 20 000 |
| 6Li | 953 | 135Xe* | 2 720 000 |
| 10B | 3 838 | 151Eu | 5 900 |
| 157Gd | 240 000 | 242Am* | 8 000 |
Tab. 1: Prvky s vysokým účinným průřezem pro pomalé neutrony.
*Nuklidy jsou radioaktivní
Do současné doby jsou rozpracovány pouze prvky 10B a 157Gd. Klinické použití má pouze 10B. Zachycení 157Gd má za následek vytvoření excitovaného jádra 158Gd, přičemž se emituje energie (7,94 MeV) ve formě záření beta a gama. Fotony a elektrony uvolněné při reakci budou předávat energii na mnohem delší dráze než produkty reakce s bórem, takže většina energie je transportována a ukládána daleko od místa kolize v nádorové buňce, což je pochopitelně nežádoucí. Následující graf srovnává výsledky léčby několika méně agresivních typů mozkových tumorů různými léčebnými metodami (H. Hanaka).
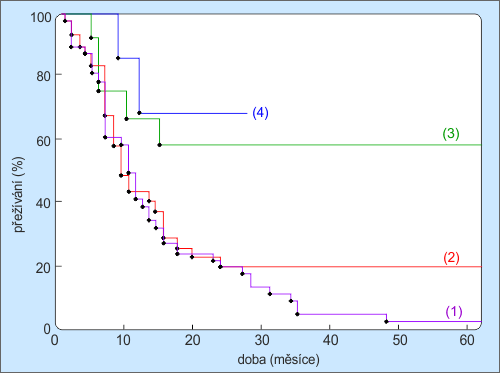
Obr. 20: Výsledky léčby mozkových nádorů typu gliomů a melanomů: (1) konvečním zářením X; (2) BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony. (12 melanomů, 128 gliomů); (3) BNCT, kdy nádor neležel hlouběji než 4-6 cm; (4) BNCT po roce 1986.
Jako nosiče se používá sůl BSH (Na210B12H11SH), případně aminokyselina BPA (C9H12BNO4). Aplikované dávky jsou 10 až 80 mg na kilogram hmotnosti pacienta. Specifický příjem těchto látek je zajištěn tím, že pouze rakovinné buňky v mozku rostou (dělí se), zatímco u zdravých funkčních buněk mozku je schopnost dělení značně omezena, nebo zcela chybí.
Po aplikaci nosiče je třeba 6 až 8 h vyčkat na ustavení rovnováhy, kdy tělo přebytek nenavázaného nosiče vyloučí močí. Poměr navázaného nosiče v nádoru a v krvi je pak až 4 : 1, poměr v nádoru a v okolní tkáni je ještě vyšší.
Další fází je ozáření pomalými neutrony. Dříve se používal přímo svazek tepelných neutronůTermální neutrony – neutrony s energií nižší než jeden elektronvolt, ale protože nádory leží hlouběji než 0,5 cm docházelo k velké zátěži povrchové tkáně. Proto byl zvolen svazek epitermálních neutronůEpitermální neutrony – neutrony s energií ležící mezi termálními (neutrony s energií nižší než 1 eV) a rychlými (neutrony s energií vyšší než 100 keV). (nejefektivnější s energií 20 keV), který se moderuje postupně pružnými srážkami při průchodu tkání a maximum fluence pak leží v hloubce 4 až 6 cm pod povrchem hlavy. Díky relativně vysokému účinnému průřezu 10B (3 838 barnůbarn – jednotka plochy (10−28 m2), ve které se měří účinný průřez srážek. Inverzní femtobarn (fb−1) je mírou počtu srážek na femtobarn cílového účinného průřezu, jde o jednotku tzv. luminosity.) pro záchyt pomalých neutronů dojde k reakci 10B + n → 7Li + 4He + γ s velkým výtěžkem 93,69 %.
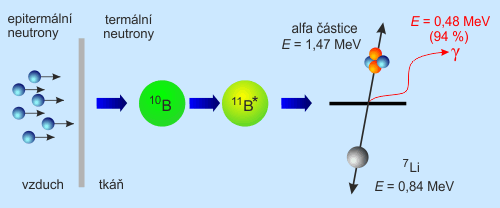
Obr. 21: Reakce probíhající při BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony.
Vzniklé lithium a α částice mají vysoký LETLET – Linear Energy Tranfer, lineární přenos energie, fyzikální veličina popisující hustotu přenosu energie z částic ionizujícího záření na látkové prostředí: LET = dE/dl. (?100 keV/µm) a tedy velmi malý dosah (8,8 a 4,8 μm), což zhruba odpovídá průměru jedné nádorové buňky (?10 μm). Deponují zde tedy veškerou svou energii, následkem čehož dochází k četným dvojným zlomům DNADNA – Deoxyribonucleic acid, deoxyribonukleová kyselina. Jde o nukleovou kyselinu, jejíž cukernou složkou je 2'-deoxyribóza. Báze jsou tvořeny především čtveřicí adenin, thymin, guanin a cytosin; vzájemně komplementární jsou nukleotidy s adeninem a thyminem, a nukleotidy s cytosinem a guaninem. DNA vytváří dvoušroubovici z navzájem komplementárních opačně orientovaných řetězců, pracovního a paměťového. Její hlavní funkcí je uchovávání genetické informace. a smrti buňky. Teoreticky lze tedy cíleně ničit jednotlivé buňky, které obsahují nezanedbatelné množství izotopu bóru 10. Při ozařování však dochází k záchytu nejen na 10B, ale i na ostatních atomech tvořících buňku. Účinné průřezy jsou naštěstí zanedbatelné (minimálně o 2 až 3 řády menší) vůči bóru. Z toho vyplývá skutečnost, že dávka v nádoru je dána především rozpadem bóru. Celková dávka v nádoru je dána součtem dávky od γ, odražených protonů, částic α a 7Li. V okolní tkáni jen od ? a odražených protonů, přičemž účinný průřez reakce je o 3 řády nižší.
V Japonsku se testovala rovněž technika přímého ozařování obnaženého mozku, vyžadující otevření lebky pacienta těsně před radioterapeutickým zákrokem. Tato metoda významně šetří tkáně ležící nad cílovým objemem, představuje však pro pacienta zátěž v podobě chirurgického zákroku.
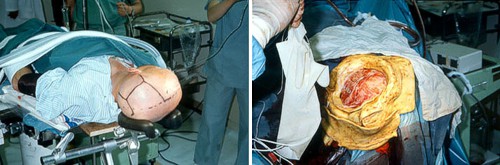
Obr. 22: Obnažení mozku pacienta před bór-neutronovou záchytovou terapií
Technická problematika
Pro BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony. je třeba svazků epitermálních neutronůEpitermální neutrony – neutrony s energií ležící mezi termálními (neutrony s energií nižší než 1 eV) a rychlými (neutrony s energií vyšší než 100 keV). o fluenci minimálně 108 cm−2s-1. V současnosti je jediným zdrojem jaderný reaktor. Ovšem představa, že by nemocnice měly svůj vlastní jaderný reaktor, je ekonomicky i politicky neprůchodná.
Dalším možným zdrojem k získávání epitermálních neutronů je bombardování lithiového terčíku protonovými svazky z urychlovače o nízkých energiích (2 až 3 MeV). Tato alternativa se zdá být jednodušší a vhodnější pro klinické použití (výrazně nižší cena, kratší ozařovací časy). První prototyp byl sestrojen v Berkeley Lab (USA).
Jako zdroj neutronů pro BNCT by mohl být použit také zdroj 252Cf (m ? 1 g). Tato možnost je ale velmi nákladná – samotný radionuklid, který při svém rozpadu emituje přímo neutrony, je velice drahý a vzhledem k poměrně krátkému poločasu rozpadu 966,09 ± 2,92 dne je nutná jeho častá výměna.
Problémem je také přesné stanovení koncentrace bóru v nádoru, tkáni a krvi pacienta. Doposud se používá magnetická rezonance a iontová mikroskopie.
Biologická problematika
Po aplikaci nosiče pacientovi se setkáváme s první překážkou a tou je hematoencefalická bariéraHematoencefalická bariéra – souvislá vrstva endotelu mozkových kapilár, bazální membrána a z mozkové strany vrstva astrocytů. Endotel mozkových kapilár se odlišuje od endotelu v jiných tkáních tím, že je bez fenestrací (pórů) a endotelové buňky jsou spojeny těsnými kontakty (tight junctions). K bazální membráně jsou připevněny výběžky astrocytů společně s mikrogliálními buňkami. Z krve do mozku snadno prostupuje voda a látky dobře rozpustné v lipidech (např. etanol, nikotin, O2, CO2, N2O). Nezbytné hydrofilní látky (glukóza, neutrální aminokyseliny) musí být do mozku aktivně transportovány pomocí specifických transportních systémů spotřebovávajících energii. Díky tomu může být výměna látek mezi krví a mozkovou tkání regulována. – přirozená ochrana mozku proti průniku cizích látek. Tato bariéra je tvořena velmi těsně semknutými buňkami. Má-li skrz proniknout větší molekula, musí se využít aktivního buněčného transportu. Nosič BPA využívá tohoto transportu, avšak klinické zkoušky ukazují, že ne všechny nádorové buňky jej přijmou. Proto je třeba hledat lepší bórové sloučeniny použitelné pro BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony.. Nejnovějším nosičem je látka nazvaná BOPP (boronated (proto)-porphyrin) nesoucí 40 atomů 10B.
Další otázkou je frakcionace. BNCTBNCT – Boron Neutron Capture Therapy, bór neutronová záchytová terapie. Terapeutický postup, při němž se do nádorového ložiska pomocí vhodné sloučeniny, která se přednostně vychytává a akumuluje v nádorové tkáni, navážou vhodné atomy, jejichž jádra mají vysoký účinný průřez pro záchyt neutronů. Následuje ozařování epitermálními neutrony. využívá záření s vysokým LETLET – Linear Energy Tranfer, lineární přenos energie, fyzikální veličina popisující hustotu přenosu energie z částic ionizujícího záření na látkové prostředí: LET = dE/dl., převážná většina vzniklých poškození je ireparabilních. Nedochází k synchronizaci buněk v radiosenzitivní fázi a oxygenace pro tento typ záření prakticky nemá vliv. BNCT probíhá při současném vystavení záření γ, tedy záření s nízkým LET. Zdrojem (kromě samotného reaktoru) je též reakce H(n, γ)D. Pro standardní situaci je poměr dávky od záření s vysokým LET (zahrnující i protony z reakce N(n,p)C) ku záření s nízkým LET 10 : 1 při toku 3×1012 cm−2s-1. Vzhledem k těmto skutečnostem se používá frakcionace 3× až 6× v rozmezí 5 až 10 dnů.
Aplikace BNCT na další typy nádorů je závislá především na schopnosti nádoru vychytávat nosiče bóru. Je třeba nalézt optimální nosiče pro každý typ nádoru a poté výsledky léčby porovnat s jinými terapeutickými metodami. Pro další experimenty byly vybrány buňky plic, u nichž dosahuje akumulační poměr pro BPA (dihydroxyboralfenylalanin) až hodnoty 7, gliosarkomu (3,2) a prostaty (2,4).
Závěr
Ve čtyřech bulletinech jsem se pokusil laicky přiblížit hlavní směry a alespoň nejzákladnější historické souvislosti oboru radiační onkologie. Oboru svým rozsahem natolik komplexního, že jsem se musel zaměřit pouze na jednu jeho část – teleterapiiTeleterapie – část radioterapie, při níž se zdroj záření nalézá vně ozařované tkáně a v definované vzdálenosti od povrchu těla pacienta. ionizujícím zářením. Dále prakticky ignorovat „neviditelné podhoubí“ tohoto oboru, jako je dozimetrie, plánování, simulace a verifikace radioterapeutických výkonů, což je vlastně to nejnáročnější (časově, personálně i technologicky). Ačkoli jsem se omezil pouze na onu pověstnou třešničku na dortu (či spíše špičku ledovce) – teleterapeutické metody a přístroje, jimiž jsou prakticky realizovány – věřím, že seriál si své čtenáře našel, zaujal a předal i řadu cenných informací, neboť statistiky jsou neúprosné a nádorové onemocnění postihne během života minimálně třetinu z nás bez ohledu na věk, pohlaví, či barvu pleti.
Konec
Odkazy
