|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Role kationtů v radiačním poškození
Eva Muchová, Josef Filgas
Chemiky na rozdíl od fyziků zajímají hlavně molekuly, k čemu je můžeme využít a jak je donutit dělat něco, co bychom chtěli. Chemické vlastnosti molekul jsou zakódovány v elektronovém obalu, a tak potřebujeme nástroj, jak se specificky dívat právě na něj.

Umělecká vize struktury atomu. Zdroj: Adobe Stock/agsandrew.
|
Elektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. Fotoelektrický jev – vyrážení elektronů z povrchu některých látek (zejména kovů) světlem. Při tomto jevu se projevují částicové vlastnosti světla, jednotlivý foton musí mít energii vyšší než je výstupní práce nutná k vytržení elektronu z atomu. Jev poprvé objevil Heinrich Hertz v roce 1887 a vysvětlil Albert Einstein v roce 1905. Synchrotronní záření – záření generované relativistickými elektrony rotujícími kolem magnetických siločar nebo elektrony kmitajícími v měnícím se magnetickém poli. Jde o záření s výraznou polarizací, ze které je možné určit směr magnetického pole. Záření je polarizováno v rovině dráhy elektronu, soustředěno do úzkého kužele, vyzařováno v původním směru pohybující se částice a má spojité spektrum. BESSY – zdroj synchrotronního záření umístěný v Berlíně (Berliner Elektronenspeicherring-Gesellschaft für Synchrotronstrahlung). První zdroj byl zprovozněn v roce 1981, obíhající elektrony měly energii až 800 MeV. Následovník BESSY II funguje od roku 1998 a zářící elektrony mají energii až 1,7 GeV. |
Fotoelektronová spektroskopie
Elegantní možností, jak „vidět“ elektrony v molekulách, je fotoelektronová spektroskopie. Ta je založená na fotoelektrickém jevuFotoelektrický jev – vyrážení elektronů z povrchu některých látek (zejména kovů) světlem. Při tomto jevu se projevují částicové vlastnosti světla, jednotlivý foton musí mít energii vyšší než je výstupní práce nutná k vytržení elektronu z atomu. Jev poprvé objevil Heinrich Hertz v roce 1887 a vysvětlil Albert Einstein v roce 1905., který správně interpretoval už v roce 1905 Albert Einstein a v roce 1921 za něj dostal Nobelovu cenu. Když na molekuly nebo pevné látky svítíme světlem s dostatečnou energií, můžeme vyrazit z povrchu látek elektrony. Když budeme měřit jejich počet a kinetickou energii, dozvíme se, kolik elektronů je jakou silou v molekule vázaných, a můžeme tak přesně poznat elektronovou strukturu a látku tím identifikovat! Na to se dá použít rovnice:
E = hν = Ekin + Φ,
která říká, že celková energie příchozího fotonu (E) se musí rovnat kinetické energii vyraženého elektronu (Ekin) plus energii potřebné k vyražení elektronu z látky (výstupní práce, označujeme ji symbolem Φ). Celý proces je zobrazen na obrázku 1. Aby bylo možné přesně měřit kinetickou energii odlétajících elektronů, je nutné mít v experimentu ultravysoké vakuum (alespoň 10−7 Pa), ale s rozvojem vakuových pump to pro pevné nebo plynné vzorky přestalo být již v 50. a 60. letech větším problémem. Fotoelektronová spektroskopie se tak hlavně díky švédskému fyzikovi Kai Siegbahnovi stala mocným nástrojem chemické analýzy (v roce 1967 publikoval obrovské množství experimentálních dat a metodu nazval ESCA (Electron Spectroscopy for Chemical Analysis), Nobelova cena za fyziku mu byla udělena v roce 1981.
Jediné, co nebylo možné dobře zkoumat, byly kapaliny, hlavně ty těkavé. Nad každou hladinou kapaliny je v rovnováze její pára, a čím je kapalina těkavější, tím víc páry tam je. Molekuly páry ale zabraňují odlétajícímu elektronu doletět k detektoru, a tím celý experiment spolehlivě pokazí.
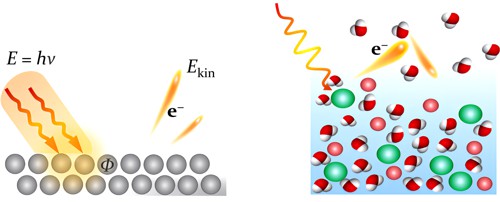
Obr. 1: Schéma fotoelektronového jevu v pevných látkách a v kapalinách.
Zdroj: Autoři.
Využití mikrotrysek
Průlomem byl až vývoj tzv. kapalných mikrotrysek (angl. liquid microjets) spojený hlavně s Manfredem Faubelem a v současnosti s Berndem Winterem z Institutu Fritze Habera v Berlíně. V experimentu se do vakua kapalina zavádí pomocí mikrotrysky o průměru pouhých 30–75 μm. Z kapaliny se sice ve vakuu téměř okamžitě stává kus ledu, ale to nevadí, protože detektor je umístěný ještě před tím a vyletující elektrony se s molekulami páry prakticky nestihnou srazit. Většina dnešních studií se provádí na synchrotronovém zařízení BESSYBESSY – zdroj synchrotronního záření umístěný v Berlíně (Berliner Elektronenspeicherring-Gesellschaft für Synchrotronstrahlung). První zdroj byl zprovozněn v roce 1981, obíhající elektrony měly energii až 800 MeV. Následovník BESSY II funguje od roku 1998 a zářící elektrony mají energii až 1,7 GeV. v Berlíně, v komplexu DESYDESY – Deutsches Elektronen SYnchrotron, německé výzkumné centrum částicové fyziky s laboratořemi v Hamburku a Zeuthenu, které bylo založeno v roce 1959. K nejvýznamnějším zařízením patří synchrotronový zdroj záření PETRA III (obvod 2,3 km) a velký evropský laser na volných elektronech European XFEL s délkou 3,4 km, který byl uveden do provozu v září 2017. v Hamburku, v laboratoři MAX-Lab na synchrotronovém zařízení v Lundu, na Advanced Light Source v Berkeley a na univerzitě v Göttingenu.
Tato nová technika je úplně zásadní pro měření kapalné vody a vodných roztoků a má obrovský potenciál. Umožňuje totiž několik jinak těžko dosažitelných věcí – třeba nahlížet do elektronové struktury látek v roztoku (to nám dává možnost „vidět“, jak molekuly interagují s okolními molekulami rozpouštědla), studovat chování molekul v různých hloubkách roztoku (to je důležité například pro atmosférickou chemii) nebo sledovat, jestli bychom světlem s vyšší energií také nemohli v kapalinách nějaké nové a zajímavé děje iniciovat.
Když ve fotoelektronové spektroskopii použijeme světlo o vyšší energii (v rentgenové oblasti s energií několik stovek až tisíců elektronvoltůElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K.), můžeme vyrazit i elektrony z vnitřních slupek. Ty jsou lokalizované v blízkosti atomového jádra, a můžeme si tedy velmi dobře v molekule různé atomy vybírat. Po vyražení vnitřního elektronu vytvoříme molekulu, která je extrémně excitovaná a své přebytečné energie se potřebuje rychle zbavit. U lehkých atomových jader (prvky první a druhé periody) nejčastěji dochází k tzv. Augerovu ději. Při něm v rámci ionizovaného atomu jeden elektron z vyšších slupek zaplní „díru“ po vnitřním elektronu, což uvolní velké množství energie a z molekuly vyletí další elektron, tzv. Augerův elektron. Ten ve fotoelektronové spektroskopii můžeme pohodlně detekovat. Protože Augerův elektron vyletuje hlavně z valenční oblasti, můžeme se zase dozvědět informace o této části elektronové struktury molekuly. V poslední době se ale ukazuje, že Augerův děj nemusí být jen lokální a do relaxace mohou být zapojené i okolní molekuly rozpouštědla, což s sebou nese zajímavé jevy.
V roce 2017 byl poprvé jeden velmi nelokální děj pozorován ve vodném roztoku LiCl (předtím byl pozorován pouze v klastrech vzácných plynů). LiCl se ve vodě rozpadá na lithný kationt Li+ a chloridový anion Cl−. Kationt Li+ má jen dva vnitřní elektrony a když jeden z nich rentgenovým světlem vyrazíme (Li2+), kationtu nezbývá žádná rozumná možnost jak relaxovat a musí využít okolní molekuly vody v tzv. ETMD procesu (Electron-Transfer Mediated Decay). Při tomto procesu se díra v Li2+ zaplní elektronem z nejbližší molekuly vody a uvolněná energie vyrazí elektron z jiné okolní molekuly vody. Na konci procesu se tak vedle obnoveného iontu Li+ nachází dvě ionizované molekuly vody a vyletuje velmi pomalý ETMD elektron (s energií několika málo desítek elektronvoltů). Tento děj je znázorněn na obrázku 2.
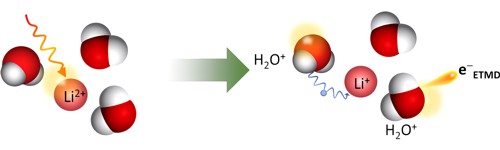
Obr. 2: Schéma ETMD procesu. Po vyražení vnitřního elektronu vzniká Li2+. V ETMD procesu je díra zaplněna elektronem z okolní molekuly vody a uvolněná energie vyrazí elektron (e−ETMD) z jiné molekuly vody. Zdroj: Autoři.
Ionty kovů v radiační chemii
V biologii je známé, že jak ionizované molekuly vody, tak pomalé elektrony poškozují biomolekuly a jsou mnohem škodlivější než přímé poškození zářením. A v ETMD procesu tyto reaktivní částice mohou ve velkém vznikat v okolí iontů. Přirozenou otázkou je, jestli se tento mechanizmus vyskytuje i u jiných kationtů, protože lithium velkou relevanci v přírodě nemá. V roce 2016 byl podobný mechanizmus teoreticky předpovězen pro ionty hořčíku Mg2+. Experimentální potvrzení je ale velmi obtížné a podařilo se až v roce 2023 pro jiný kationt – pro Al3+. Kationt Al3+ má významně víc elektronů než lithný kationt a po vyražení vnitřního 1s elektronu může následovat celá kaskáda lokálních a nelokálních procesů. Experimentálním týmům z Berlína, Paříže a Uppsaly se spolu s kvantovými chemiky z Prahy podařilo rozklíčovat ETMD signál a přiřadit ho jednotlivým ultrarychlým relaxačním procesům. Ukázalo se, že relaxace probíhá ve třech krocích – ionizovaný kationt nejdříve podléhá lokálnímu Augerovu ději a vzniká Al5+. Ten je ale ve vodném roztoku velmi nestabilní a přebytečné energie se zbaví dvěma následnými ETMD procesy (viz obrázek 3). Celkově tedy kolem ionizovaného kationtu vznikají čtyři ionizované molekuly vody a dva pomalé elektrony a celý děj se může dále opakovat!
Tyto výsledky mají velmi důležité důsledky pro roli iontů kovů v radiační chemii. Přímo se totiž ukazuje, že ozáření rentgenovým zářením nezpůsobuje náhodnou ionizaci, ale spíše rozsáhlou a velmi lokalizovanou ionizaci vody v okolí kovových iontů a můžeme hovořit o vzniku ionizačních horkých míst (hot-spots).
Studované ionty Al3+ jsou zatím důležitým modelem pro další, relevantnější kationty. U kationtů s vyšším protonovým číslem bude po ionizaci vnitřních elektronů pravděpodobně následovat podobná kaskáda, ale s větším počtem kroků, čímž dojde ještě k masivnější ionizaci a produkci dalších pomalých elektronů. Je možné si představit, že podobné procesy budou probíhat také při ionizaci atomů kovů například v metaloproteinechMetaloproteiny – bílkoviny, které obsahují kovy jako nebílkovinnou část, která zajišťuje katalytickou funkci. Příkladem je třeba známý hemoglobin, který obsahuje kationty železa., což by vedlo k velmi rozsáhlému lokálnímu poškození molekul.
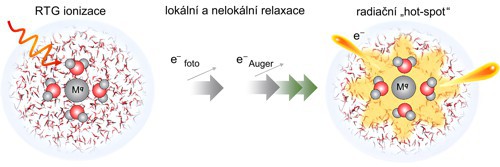
Obr. 3: Schéma kaskády ultrarychlých procesů po rentgenové ionizaci kationtu Al3+. V kaskádě lokálních a nelokálních relaxačních dějů vzniká kolem kationtu řada ionizovaných molekul vody a pomalých elektronů, které jsou zdrojem radiačního poškození. Zdroj: upraveno podle [5].
Odkazy
- Léon Sanche: Beyond radical thinking; Nature 461 (2009) 358–359
- Vasili Stumpf, Kirill Gokhberg, Lorenz S. Cederbaum: The role of metal ions in X-ray-induced photochemistry; Nature Chemistry 8 (2016) 237–241
- Bruce C. Garrett et al.: Role of Water in Electron-Initiated Processes and Radical Chemistry: Issues and Scientific Advances; Chem. Rev. 105/1 (2005) 355–390
- Isaak Unger et al.: Observation of electron-transfer-mediated decay in aqueous solution; Nature Chemistry 9 (2017) 708–714
- Geethanjali Gopakumar et al.: Radiation damage by extensive local water ionization from two-step electron-transfer-mediated decay of solvated ions; Nature Chemistry 15 (2023) 1408–1414
