|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Nízkoteplotní plazma VII – srážky v plazmatu III
Josef Khun, Vladimír Scholtz
V předchozích dvou bulletinech (AB 2012/47, AB 2013/4) jsme popsali srážky elektronůElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. a fotonůFoton – základní kvantum energie elektromagnetického záření, polní částice elektromagnetické interakce. Má nulovou klidovou hmotnost a nemá elektrický náboj. Jeho energie a hybnost jsou přímo úměrné frekvenci záření (E = ħω, p = E/c). Stav fotonu zahrnuje také polarizaci, protože jde o příčné vlnění. Kvantování energie poprvé zavedl Max Planck při pokusech o vysvětlení záření černého tělesa. Albert Einstein dal těmto kvantům reálný význam v roce 1905 při vysvětlení fotoelektrického jevu. Samotný název foton poprvé pro tuto částici použil až americký fyzikální chemik Gilbert Lewis v dopise časopisu Nature z roku 1926. s neutrálními, excitovanými nebo ionizovanými těžkými částicemi. Tyto srážky představují elementární procesy v plazmatu a elektrických výbojích z hlediska jejich udržení a chování a většinou nemají vliv na chemické změny plazmatu. Naopak vzájemné srážky těžkých částic nemají, alespoň co se týká nízkoteplotního plazmatu, na fyzikální vlastnosti plazmatu a výbojů tak zásadní vliv, ale dochází při nich k důležitým změnám v chemickém složení.
|
Plazma – kvazineutrální soubor nabitých a neutrálních částic, který vykazuje kolektivní chování. Lidsky to znamená, že se v dané látce nachází elektricky nabité částice. Kladné a záporné náboje se navzájem kompenzují, takže celek je elektricky neutrální. Částice jsou schopné reagovat na elektrická a magnetická pole jako celek. Plazma vzniká odtržením elektronů z elektrického obalu atomárního plynu nebo ionizací molekul. S plazmatem se můžeme setkat v elektrických výbojích (blesky, jiskry, zářivky), v polárních zářích, ve hvězdách, ve slunečním větru a v mlhovinách. Pro plazma jsou typické silně nelineární jevy a nestability. Přes 99 % atomární látky ve vesmíru je v plazmatickém skupenství. Termální plazma – plazma, v němž je vyrovnána teplota všech komponent, tj. eletrony, ionty i vícenásobné ionty mají stejnou teplotu. Metastabilní stavy – stavy s dlouhou dobou života částice. Excitovaná částice přechází samovolně do nižšího energetického stavu při vyzáření fotonu za typickou dobu 10−8 s. Elektron se ale v atomu nebo molekule může nacházet v takovém excitovaném stavu, z něhož jsou díky výběrovým pravidlům optické přechody do nižšího energetického stavu, při nichž je vyzářen foton, zakázány. Pravděpodobnost přechodu do nižšího energetického stavu je proto velmi nízká a doba života takového stavu částice může být 10−3 s a více. Částice se v tomto stavu nazývá metastabilní. Metastabilní částice ztrácejí svou energii zpravidla srážkami s jinými částicemi. V plazmatu se uplatňují jako zásobárna energie, kterou je možno využít jak pro interakce v plazmatu, tak i pro interakci plazma-pevná látka například při modifikaci povrchů. Střední volná dráha – průměrná vzdálenost mezi srážkami. V plazmatu, kde dochází jen k odklonu nabité částice z původního směru vlivem elektrických sil, chápeme střední volnou dráhu jako takovou vzdálenost, na které se částice v průměru odchýlí od původního směru o 90°. |
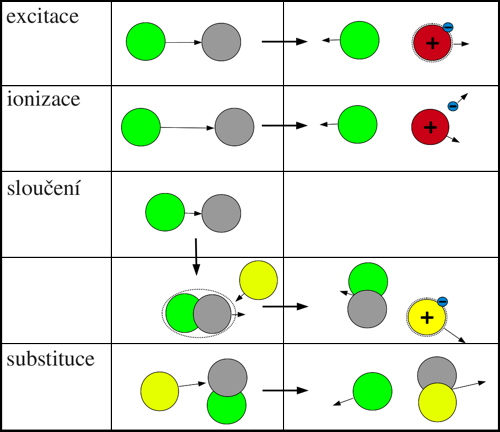
Srážka dvou těžkých neutrálních částic
Pokud má elektronElektron – první objevená elementární částice. Je stabilní. Hmotnost má 9,1×10−31 kg a elektrický náboj 1,6×10−19 C. Elektron objevil sir Joseph John Thomson v roce 1897. Existenci antičástice k elektronu (pozitron) teoreticky předpověděl Paul Dirac v roce 1928 a objevil Carl Anderson v roce 1932. při srážce s těžkou částicí (atomem či molekulou) kinetickou energii rovnou alespoň ionizační energii těžké částice, může s relativně vysokou pravděpodobností dojít k ionizaci. Je tomu tak z důvodu, že narážející elektron má mnohem menší hmotnost než těžké částice a tudíž se při srážce téměř zastaví a většinu své kinetické energie může proměnit v jinou formu energie (excitační, ionizační atd.). Srážku elektronu s těžkou částicí si lze zjednodušeně představit tak, že volný pohybující se elektron naráží do elektronu uvnitř elektronového obalu částice. Jde o srážku dvou stejně těžkých částic, které si během ní vyměňují kinetickou energii snadno, protože mají stejné setrvačné vlastnosti. Při vzájemných srážkách těžkých částic je situace jiná. Z hlediska možnosti ionizace či excitace si lze srážku dvou těžkých částic přibližně představit jako srážku těžké narážející částice s lehkým elektronem druhé částice. V tomto případě je těžká částice s dostatečnou kinetickou energií k ionizaci pořád relativně pomalá a tudíž si, vzhledem ke své hmotnosti, po srážce s lehkým elektronem ponechá podstatnou část své kinetické energie. Pokud například těžká částice pružně naráží do 10 000× lehčí částice, po srážce si ponechá až 99,96 % své kinetické energie. Vyplývá to ze zákona zachování energie a hybnosti a případného zájemce odkazujeme na libovolnou učebnici fyziky, kapitolu pružných a nepružných srážek.
Dostatečná kinetická energie těžké částice v základním stavu, potřebná pro ionizaci jiné těžké částice, závisí na typu částic a pohybuje se v rozmezí 10 keVElektronvolt – jednotka energie. Jde o energii, kterou získá elektron urychlením v potenciálovém rozdílu jeden volt, 1 eV = 1,6×10−19 J. V jaderné fyzice se používají spíše větší násobky této jednotky, kiloelektronvolt keV (103 eV), megaelektronvolt MeV (106 eV), gigaelektronvolt GeV (109 eV), teraelektronvolt TeV (1012 eV) nebo petaelektronvolt PeV (1015 eV). V těchto jednotkách se také vyjadřuje hmotnost (E=mc2) a teplota (E=kBT). Jeden elektronvolt odpovídá teplotě přibližně 11 600 K. až 100 keV. To je o tři až čtyři řády vyšší energie v porovnání s energií ionizační (atomy a molekuly jsou také o tři až čtyři řády těžší než elektron). Tak vysoké energie se v nízkoteplotním plazmatu běžně nevyskytují, jsou však běžné v plazmatu termálnímTermální plazma – plazma, v němž je vyrovnána teplota všech komponent, tj. eletrony, ionty i vícenásobné ionty mají stejnou teplotu.. Tudíž i k následujícím reakcím pro excitaci a ionizaci dochází převážně v plazmatu termálním:
X + Y → X* + Y, nebo
X + Y → X + Y+ + e−.
Při srážkách dvou těžkých částic však může docházet ke změnám jejich chemických vlastností. V tomto případě spíše hovoříme o reakci než o srážce.
Sloučení (asociace)
Při sloučení dvou částic dochází ke vzniku nové chemické sloučeniny a uvolnění energie, která musí být odvedena jinou částicí M:
X + Y + M → XY + M.
Při sloučení částic X a Y se uvolní energie, která určitým způsobem tuto molekulu excituje. Aby nedošlo k opětovnému rozpadu, musí být v průběhu reakce přítomna třetí kolizní částice M, která absorbuje přebytečnou energii. Tato energie se přemění například na excitační nebo kinetickou energii částice M. Částice M se na reakci chemicky nepodílí, tudíž se nemění její chemické vlastnosti.
Příkladem asociace mohou být oxidačně-redukční reakce, tj. případ, kdy se částice musí vyznačovat dostatečným tzv. redoxním potenciálem. Rozhodující zde již tedy není kinetická energie narážejících částic, ale jejich reaktivita. Příkladem může být reakce (ve vzduchu za atmosférického tlaku) atomárního kyslíku s oxidem dusnatým za vzniku oxidu dusičitého:
O + NO + N2 → NO2 + N2,
nebo reakce atomárního a molekulárního kyslíku za vzniku ozonu:
O + O2 + N2 → O3 + N2 .
V obou reakcích vystupuje molekula N2, která odvádí energii uvolněnou při sloučení.
Substituce
Po srážce částice A (obecně může být i excitovaná nebo ionizovaná) s molekulou BC může vzniknout molekula AB a částice C
A + BC → AB + C.
Příkladem může být opět oxidačně-redukční reakce atomárního dusíku a molekulárního kyslíku za vzniku atomárního kyslíku a oxidu dusnatého:
N + O2 → NO + O.
Obr. 1: Přehled procesů při srážce dvou těžkých neutrálních částic.
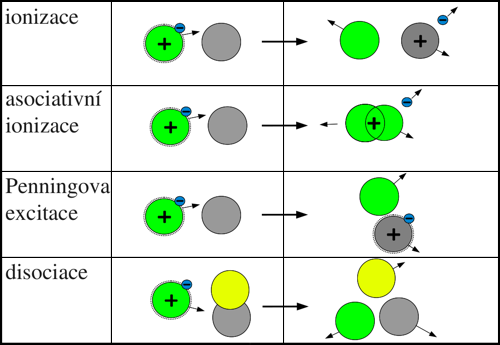
Srážka neutrální částice s excitovanou částicí
Jak již bylo uvedeno výše, při srážce dvou těžkých částic v základním stavu, z nichž jedna částice má kinetickou energii srovnatelnou s excitační či ionizační energií druhé částice, k ionizaci či excitaci nedochází. Jiná situace ale nastává v případě srážek dvou těžkých částic, kde alespoň jedna z nich se nachází v elektronově excitovaném stavu. V tomto případě se totiž nepřeměňuje energie kinetická, ale dochází k přenosu energie excitační z částice excitované na neexcitovanou, která bude excitována nebo ionizována.
Ionizace
Pokud je celková energie elektronově excitovaných stavů při srážce dvou těžkých částic blízká ionizační energii jedné z nich, může dojít k přenosu energie a nastává ionizace. Tento typ ionizačního procesu má v principu dva možné scénáře:
-
Penningova ionizace. V případě, že je energie elektronově excitovaného stavu částice X* vyšší než ionizační energii částice Y, může při srážce dojít k přenosu energie z částice X* na částici Y. Částice Y může být ionizována a případná zbývající energie se promění v kinetickou energii uvolněného elektronu a částice Y.
X*+ Y → X + Y+ + e−.
V elektrických výbojích dochází nejčastěji k Penningově ionizaci molekul a atomů N2, CO2, Xe a Ar srážkou s excitovanými metastabilnímiMetastabilní stavy – stavy s dlouhou dobou života částice. Excitovaná částice přechází samovolně do nižšího energetického stavu při vyzáření fotonu za typickou dobu 10−8 s. Elektron se ale v atomu nebo molekule může nacházet v takovém excitovaném stavu, z něhož jsou díky výběrovým pravidlům optické přechody do nižšího energetického stavu, při nichž je vyzářen foton, zakázány. Pravděpodobnost přechodu do nižšího energetického stavu je proto velmi nízká a doba života takového stavu částice může být 10−3 s a více. Částice se v tomto stavu nazývá metastabilní. Metastabilní částice ztrácejí svou energii zpravidla srážkami s jinými částicemi. V plazmatu se uplatňují jako zásobárna energie, kterou je možno využít jak pro interakce v plazmatu, tak i pro interakci plazma-pevná látka například při modifikaci povrchů. atomy He* nebo Ne*. Excitační energie metastabilních atomů He* je 19,8 eV a metastabilních atomů Ne* je 16,6 eV. Tyto energie převyšují ionizační energie uvedených částic, které jsou Ei (N2) = 15,6 eV, Ei (CO2) = 13,8 eV, Ei (Xe) = 12,1 eV, Ei (Ar) = 15,8 eV. V předešlé obecné reakci je tedy excitovanou částicí X* například excitovaný metastabilní atom He*. Pokud se tento atom srazí s molekulou N2, může dojít k přenosu energie z excitované částice a k následné ionizaci:
He* + N2 → He + N2+ + e−.
- Asociativní ionizace. Pokud je celková excitační energie částic při srážce menší než energie ionizační, nemůže dojít k přímé Penningově ionizaci. K ionizaci však může dojít v případě, že při srážce dojde ke sloučení (asociaci) částic X* a Y na molekulu XY, jejíž ionizační energie je nižší než celková excitační energie před srážkou. V tomto případě dochází k ionizaci s přispěním uvolněné vazební energie. Reakci je možno zapsat:
X*+ Y(*) → (XY)+ + e−,
kde i druhý vstupní reaktant může být excitovaný. Příkladem asociativní ionizace je srážka dvou metastabilních atomů rtuti v různých excitovaných stavech. Energie metastabilních excitovaných stavů jsou uvedené v závorce:
Hg*(E = 4,9 eV) + Hg*(E = 4,7 eV) → Hg2+ + e−.
Je vidět, že celková energie excitovaných stavů vstupních reaktantů při srážce je 9,6 eV. Tato energie je menší než ionizační energie atomů rtuti Ei (Hg) = 10,4 eV, ale zároveň vyšší, než ionizační energie molekuly Hg2, která je Ei (Hg2) = 9 eV. Asociativní ionizace může být významná v počáteční fázi vzniku výboje ve slabě ionizovaném plazmatu (například bezprostředně po průchodu rázové vlny), kdy je koncentrace elektronů ještě relativně nízká.
X* + Y → X + Y*.
Penningova excitace
V případě, že excitační energie částice X* je nižší než ionizační energie částice Y, ale postačuje k její excitaci, může dojít k přenosu energie, a tím k excitaci částice Y:
X*+ Y → X + Y*.
Disociace
Při srážce excitované částice X* s molekulou AB, může být excitační energie využita k rozdělení molekuly na částice v základním či excitovaném stavu nebo může dojít až k jejich ionizaci:
X* + AB → X + A(*) + B(*),
X* + AB → X + A+ + B + e−.
Příkladem je reakce excitované molekuly dusíku s molekulou kyslíku:
N2* + O2 → N2 + O + O.
Obr. 2: Přehled procesů při srážce neutrální částice s excitovanou částicí.
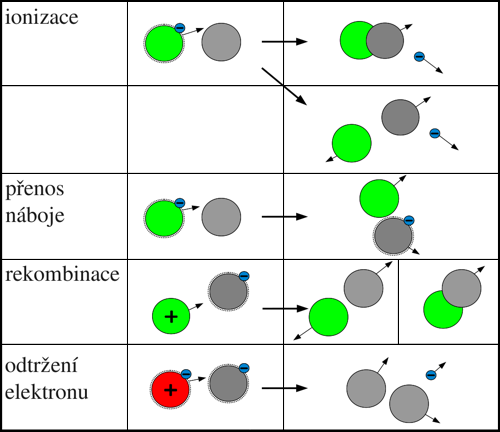
Srážka záporného iontu s neutrální částicí
Odtržení elektronu
Pokud jsou kinetické energie vstupních reaktantů A a B jen několik eV nebo menší, může při srážce dojít ke vzniku molekuly AB. Uvolněná vazební energie spolu s kinetickou energií částic před srážkou je použita k uvolnění elektronu. Tento proces může proběhnout přímo nebo přes excitovaný mezistav:
A− + B → (AB) + e−,
A− + B → (AB−)* → (AB) + e−.
Při vyšších kinetických energiích srážejících se částic může dojít opět k oddělení elektronu ze záporného iontu bez sloučení do molekuly:
A− + B → A + B + e−.
Přenos náboje
V některých případech nemusí dojít k uvolnění elektronu, ale pouze jeho přenosu na druhou částici:
A− + B → A + B−.
Tento typ srážek je velmi pravděpodobný v nízkoteplotním plazmatu za přítomnosti elektronegativníchElektronegativita – vlastnost prvku, která vyjadřuje jeho schopnost přitahovat elektrony (většinou souvisí se snahou prvku dosáhnout konfigurace vzácného plynu). Tuto vlastnost zavedl americký chemik Linus Pauling jako bezrozměrnou relativní veličinu. částic plynu, kde díky nízkému stupni ionizace dochází ke srážkám záporných iontů s neutrálními částicemi s větší pravděpodobností než například ke srážkám mezi ionty či mezi ionty a elektrony. V tomto případě není potřeba uvádět příklady, protože za částice A a B si je možno dosadit téměř jakoukoliv částici nacházející se v plazmatu.
Srážka záporného iontu s kladným iontem
Při této srážce dochází prakticky jenom k rekombinaci. Ze záporného iontu Y− je při srážce vytržen elektron, který je zakomponován do elektronového obalu kladného iontu X+, kde elektron chybí. Z obou účastníků reakce se tedy stávají neutrální částice, které se můžou sloučit v jednu molekulu:
X+ + Y− → X + Y,
X+ + Y− → XY.
Srážka záporného iontu s excitovanou částicí
V nízkoteplotním plazmatu dochází při srážce záporného iontu s excitovanou částicí prakticky pouze k odtržení elektronu ze záporného iontu a deexcitaci druhé částice. Toto nastane v případě, že excitační energie částice X* je větší než energie potřebná k uvolnění elektronu ze záporného iontu Y−. V některých případech, kdy je excitační energie nedostatečná, může k uvolnění pomoci i kinetická energie obou částic. Případná uvolněná energie se promění například v kinetickou energii částic:
X* + Y− → X + Y + e−.
Obr. 3: Přehled procesů při srážce záporného iontu s
neutrální částicí,
kladným iontem nebo excitovanou částicí.
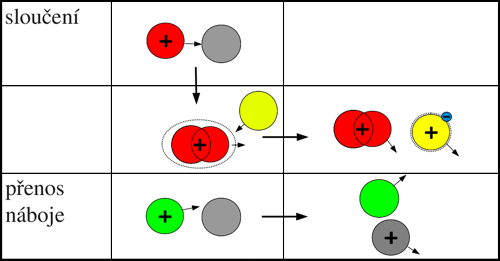
Srážka kladného iontu s neutrální částicí
Sloučení
Při tomto procesu dojde ke sloučení kladného iontu X+ s neutrální částicí Y za vzniku molekulárního iontu (XY)+. Podmínkou pro stabilitu částice (XY)+ však opět je, aby se přebytečná energie uvolněná při sloučení odčerpala jako kinetická nebo jiná energie třetí částice M, která je zrovna v blízkosti této srážky (reakce). V opačném případě by se vzniklá molekula (XY)+ mohla rozpadnout. Proces lze zapsat:
X+ + Y + M → (XY)+ + M(*).
Tento proces se uplatňuje zejména v plazmatu slabě ionizovaných plynů za tlaků p ≥ 10 kPa (1/10 atmosférického tlaku).
Přenos (výměna) náboje
Při procesu dochází k přenosu elektronu z neutrální částice Y na kladný iont X+:
X+ + Y → X + Y+.
Obr. 4: Přehled procesů při srážce kladného iontu s neutrální částicí.
Odkazy
- Y. P. Raizer: Gas Discharge Physics; Springer, 1991
- J. Kracík, J. B. Slavík, J. Tobiáš: Elektrické výboje; Státní nakladatelství technické literatury, Praha, 1964.
-
Josef Khun, Vladimír Scholtz: Nízkoteplotní plazma VI – srážky v plazmatu II; AB 2013/4
-
Josef Khun, Vladimír Scholtz: Nízkoteplotní plazma V – srážky v plazmatu; AB 2012/47