|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Belousovova-Žabotinského reakcia
Vladimír Scholtz
V prírode pozorujeme okrem oscilátorovOscilátor – Systém vykazující periodické nebo kvaziperiodické chování. Děje se tak zpravidla v okolí minima potenciální energie., ako sú kyvadlo alebo LC oscilátorLC oscilátor – elektrický obvod složený z cívky o indukčnosti L a kondenzátoru o kapacitě C. Systém vykonává harmonické oscilace s úhlovou frekvencí LC−1/2., ktoré kmitajú zo svojej podstaty, množstvo dejov, ktoré vykazujú pri vhodných podmienkach periodické chovanie. Všeobecne sa jedná o systémy, ktoré sú dostatočne vzdialené od rovnovážneho stavu a za vhodných podmienok môžu vykazovať ako časové tak aj priestorové oscilácie alebo vznik priestorových štruktúr. Takéto systémy voláme disipatívne. Príkladom vzniku časových oscilácií môže byť napríklad píšťala. Pokiaľ do píšťaly fúkame slabo, prúdenie vzduchu je laminárne, teda pozdĺžne, bez oscilácií, pokiaľ pridáme na intenzite, odrazu prechádza prúdenie do turbulencií, vznikajú oscilácie a píšťala vydáva tón. Podobne pracuje napríklad slák na strune alebo vietor v komíne. Ako príklad priestorových štruktúr je možné uviesť vznik pieskových dún alebo snehových závejov vo vetre a mnoho iných. V tomto článku popíšeme jeden konkrétny príklad oscilácií v chemických systémoch.
|
Krebsův cyklus – cyklický metabolický proces v mitochodriích buněk. Oxiduje acetylová rezidua na oxid uhličitý CO2. Je pojmenován podle německo-anglického lékaře sira Hanse Adolfa Krebse (1900–1981). Někdy se mu říká citrátový cyklus. Petriho miska – mělká skleněná nebo plastová kruhová miska s volně přiléhajícím víčkem používaná v mikrobiologii a chemii ke kultivaci kultur nebo k přípravě látek. Byla pojmenována po německém bakteriologovi Juliu Richardu Petrim (1852–1920), který ji vyvinul v roce 1877, když pracoval jako asistent Roberta Kocha. |
Objav Belousovovej-Žabotinského reakcie siaha do roku 1950, keď si už postarší profesor Belousov pri výskume katalýzy v Krebsovom cykleKrebsův cyklus – cyklický metabolický proces v mitochodriích buněk. Oxiduje acetylová rezidua na oxid uhličitý CO2. Je pojmenován podle německo-anglického lékaře sira Hanse Adolfa Krebse (1900–1981). Někdy se mu říká citrátový cyklus. všimol, že sa jeho roztok periodicky zafarbuje do žlta a potom odfarbuje, a to asi jednu hodinu pokiaľ sa uvoľňoval oxid uhličitý CO2. Bohužiaľ svoju prácu publikoval iba v neznámom zborníku (B. P. Belousov, Sbornik Referatov po Radiacionnoj Medicine, Medgiz, Moskva 1958), články v známejších časopisoch pravdepodobne zamietli recenzenti. Belousovho objavu si všimol až v roku 1961 A. M. Žabotinskij, ktorý ho ďalej študoval a prvý krát prezentoval širšej vedeckej komunite v roku 1968 na sympóziu v Prahe. Ďalšie objavy prichádzali už rýchlo, H. G. Busse objavil farebné pásy vznikajúce v roztoku umiestenom v trubici a Žabotinskij s A. N. Zajkinom pozorovali koncentrické vlny v tenkej vrstve roztoku na Petriho miskePetriho miska – mělká skleněná nebo plastová kruhová miska s volně přiléhajícím víčkem používaná v mikrobiologii a chemii ke kultivaci kultur nebo k přípravě látek. Byla pojmenována po německém bakteriologovi Juliu Richardu Petrim (1852–1920), který ji vyvinul v roce 1877, když pracoval jako asistent Roberta Kocha..

Obr. 1. Koncentrické vlny v tenkej vrstve roztoku na
Petriho miske,
vidieť bublinky vznikajúceho CO2. Zdroj [1].

Obr. 2. Zjednodušená schéma Belousovovej-Žabotinského reakcie.
Základná schéma Belousovovej-Žabotinského reakcie je znázornená na Obr. 2. Vstupné látky bromičnan BrO3– a kyselina malonová CH2(COOH)2 sa rozkladajú na bróm, kyselinu mravčiu HCOOH a oxid uhličitý CO2. Vo vnútri prebieha komplikovaný proces katalytických reakcií, ktoré za určitých okolností môžu vykazovať oscilácie alebo vznik priestorových štruktúr. Podobne ako na píšťale, pokiaľ budú vhodne nastavené parametre systému (tvar píšťaly) a „rýchlosť“ toku vstupov (rýchlosť prúdenia vzduchu), môže dôjsť k osciláciám (vydáva tón) a vzniku priestorových štruktúr (tlak vzduchu v okolí píšťaly, ten ale nevidíme).
Celkový reakčný mechanizmus Belousovovej-Žabotinského reakcie navrhli až v roku 1972 R. J. Field, E. Körös a R. M. Noyes. Skrátene je ho možno uviesť v nasledujúcich štyroch stechiometrických rovniciach (každá reakcia je iba súčtom niekoľkých reakcií a predstavuje iba výsledné pomery atómov a molekúl):
|
BrO3− + 2Br− + 3H+ + 3MA → 3BrMA + 3H2O, |
(1) |
|
BrO3– + 4Ce3+ + MA + 5H+ → 4Ce4+ + BrMA + 3H2O, |
(2) |
|
MA + 6Ce4+ + 2H2O → HCOOH + 2CO2 + 6H+ + 6Ce3+, |
(3) |
|
BrMA + 4Ce4+ + 2H2O → HCOOH + 2CO2 + 5H+ + 4Ce3+ + Br− |
(4) |
Prvé dve reakcie predstavujú vstup látok do systému. V rovniciach (1) a (2) vzniká z bromičnanu BrO3–, brómu Br− a kyseliny malonovej MA kyselina brómmalonová BrMA, pričom prvá reakcia prebieha pokiaľ je dostatok bromičnanu aj brómu, zatiaľ čo druhej reakcii postačuje bromičnan, avšak oxiduje cér z Ce3+ na Ce4+, čo spôsobuje zmenu farby roztoku. Posledné dve rovnice predstavujú výstup látok zo systému. Rovnica (3) rozkladá kyselinu malonovú na kyselinu mravčiu HCOOH súčasne so vznikom CO2 a spätnou reduckiou céru z Ce4+ na Ce3+. Rovnica (4) opäť redukuje cér, rozkladá kyselinu brómmalonovú na bróm a kyselinu mravčiu a uvoľňuje sa opäť CO2. Ďalej nám ešte v rovniciach pobehujú ióny vodíku H+ a voda, ktoré si však už čitateľ vystopuje sám.
Časový priebeh oscilácií je znázornený na Obr. 3. Na začiatku prebiehajú reakcie (1) aj (2). Postupne sa však znižuje koncentrácia Br−, takže sa reakcia (1) spomalí a ďalej pokračuje už iba reakcia (2), ktorá oxiduje cér z Ce3+ na Ce4+ . So zvyšovaním koncentrácie Ce4+ sa spúšťajú reakcie (3) a (4), ktoré opäť uvoľňujú viazaný bróm a spätne redukujú cér z Ce4+ na Ce3+. Po počiatočnej tzv. inkubačnej perióde sa systém nachádza v stacionárnom ale nestabilnom stave. (Analógiou môže byť guľôčka na vrchole kopca, je v stacionárnom stave, ale jej poloha je nestabilná. Akákoľvek malá výchylka sa bude s časom zväčšovať a guľôčka sa skotúľa do doliny.) Pri malej poruche alebo vonkajšom vzruchu sa rovnováha poruší a systém preskočí do periodického stavu, kde sa oscilácie stále opakujú. Pokiaľ máme popísanú sústavu miešanú, vzruch prichádza z miešania, celý systém osciluje a mení svoju farbu. Pokiaľ však máme popísanú sústavu v tenkej vrstve v kľude, budú prípadné poruchy v rovnováhe zriedkavé a v mieste týchto porúch začne systém oscilovať a meniť svoju farbu. Tieto oscilácie vyvolajú následné poruchy vo svojom okolí a vzniknutá porucha sa postupne šíri do priestoru. Tento efekt je výborne viditeľný v klipe na konci článku.
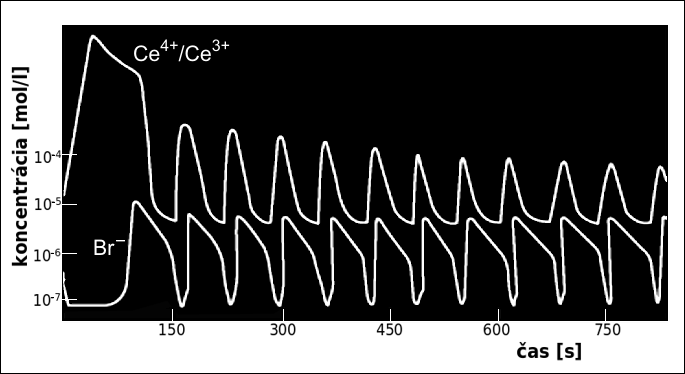
Obr. 3. Časový priebeh koncentrácie brómu a cérových iónov. Zdroj [2].
Praktická ukážka tejto reakcie je veľmi efektná. Obecný predpis je nasledujúci: voda, kyselina malonová, KBrO3 alebo NaBrO3 (vo vode sa disociuje na K+ alebo Na+ a BrO3−), H2SO4 (vo vode disociuje na H+ a SO4−), NaBr (vo vode disociuje na Na+ a Br−) a ako zdroj céru napr. dusičňan céričitoamónny Ce(NH4)2(NO3)6. Zadovážiť si dusičňan céričitoamónny nie je úplne triviálna záležitosť, preto sa v modifikovaných reakciách používa feroín – komplexná zlúčenina železa s ortho-fenantrolinom [Fe(o-phen)3]SO4, ktorý nahrádza v reakciách cér a zároveň farebne indikuje svoj stav Fe2+ (červená) a Fe3+ (modrá). Uveďme ešte dva predpisy ako si túto reakciu namiešať:
A. |
10 ml 0,48M kyseliny malonovej |
|---|---|
10 ml nasýteného roztoku KBrO3 |
|
20 ml 0,6M H2SO4, |
|
0,15 g Ce(NH4)2(NO3)6. |
|
B. |
0,35 mol/dm3 NaBrO3, |
0,35 mol/dm3 H2SO4, |
|
0,14 mol/dm3 kyseliny malónovej, |
|
0,08 mol/dm3 NaBr, |
|
10−3 mol/dm3 feroínu. |
|
C |
vyskúšaný predpis |
|
1. |
v 335 ml vody postupne rozpustite 25 g NaBrO3 a 10 ml konc. H2SO4, |
|
2. |
v 100 ml vody rozpustite 10 g NaBr, |
|
3. |
v 100 ml vody rozpustite 10 g kyseliny malonovej a . |
|
4. |
ferroín |
|
Do 6 ml roztoku (1) pridajte 0,5 ml roztoku (2) a 1 ml roztoku (3). Zamiešajte a počkajte až sa roztok odfarbí. Potom pridajte 1 ml feroínu (4), zamiešajte a reakcia môže začať. |
Na záver ešte malá poznámka k entropii a druhej vete termodynamickej, podľa ktorej v uzavretom systéme entropia nemôže klesať. V popísanej reakcii a všeobecne v podobných systémoch však dochádza ku vzniku štruktúr, teda usporiadanému stavu a poklesu entrópie. Jednoduché vysvetlenie spočíva v tom, že popisovaný systém okrem popísaných reakcií produkuje aj teplo a toto teplo nám v sústave zvyšuje entrópiu. Toto zvýšenie entrópie produkciou tepla je vždy vyššie ako pokles entrópie vznikom štruktúr.
Klip týždňa: Belousovova-Žabotinského reakcia
Belousovova-Žabotinského reakcia v tenkej vrstve v Petriho miske. Miska je v kľude a prípadné poruchy v rovnováhe sú zriedkavé. V mieste týchto porúch začne systém oscilovať a meniť svoju farbu. Tieto oscilácie vyvolajú následné poruchy vo svojom okolí a vzniknutá porucha sa postupne šíri do priestoru. Ďalej nasleduje niekoľko ukážok narušenia rovnováhy vonkajším podnetom. (avi/xvid, 5 MB)
Odkazy

