|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Nanoburlaci – kráčející molekuly I: Inspirace v buňce
Vítězslav Kříha
V AB 38/2009 jsme se seznámili s truhličkami v nanosvětě. Ono se řekne, když máme truhlu, můžeme do ní něco schovat, ale jak to udělat, když ono cosi měří pár nanometrů? Máme přinejmenším dvě možnosti: Můžeme do nanosvěta zasahovat přímo pomocí makroskopického nástroje s velejemným hrotem, který je souměřitelný s nanoobjekty a slouží jako nanopinzeta. Druhá možnost je nechat žít nanosvět svým životem podle námi vytvořených pravidel a řešit v něm otázku transportu pomocí jiných nanoobjektů. Lze si představit různé obdoby makroskopických transportních mechanismů, nanojeřáby, nanokarusely, nanoposuvné pásy, nanokatapulty či nanovozítka, avšak obvykle stačí zapřáhnout náklad pomocí nanovlákna za nanotahač. V tomto případě se můžeme nechat inspirovat burlaky bodře vykračujícími podél Volhy, kteří za sebou na laně táhli loď. Jen zpívat Ej uchněm si u toho molekuly zatím ještě neumí…

Ilja Repin: Burlaci na Volze (1870–1873)
|
Burlak – námezdná pracovní síla v carském Rusku, ochotná se za úplatu nechat zapřáhnout za loď plující po Volze a ze břehu ji za sebou vláčet na laně proti proudu. Označení prý pochází od volžského kupce Burlakova, který se vůči těmto tahounům choval čestně, za práci jim skutečně zaplatil, tudíž není divu, že byl vyhledávaný. Předchozí označení těchto pracovníků – svoloč – však také přežilo do dnešních dní coby vulgarizmus odrážející sociální poměry této skupiny obyvatel. (Původně na něm nic hanlivého nebylo a je odvozeno od slovesa vléci.) Hydrolýza – rozkladná reakce, při které se spotřebovává molekula vody. Makroergní vazba – vazba, jejímž hydrolytickým štěpením se uvolní velké množství energie. Molekuly s makroergními vazbami, makroergní sloučeniny, se účastní enzymy katalyzovaných reakcí coby zdroj energie. Důležitou roli v biochemii hrají makroergní nukleotidy tvořené ribózovým jádrem, heterocyklickými dusíkatými bázemi a několika zbytky kyseliny fosforečné. Makroergní vazba je mezi zbytky kyseliny fosforečné. V buňce tyto nukleotidy slouží jako univerzální zdroj energie pro chemické reakce vedoucí například k syntéze nových sloučenin, transportu iontů, či pohybu. ATP – adenosintrifosfát, nejznámější makroergní nukleotid. Při hydrolýze na adenosindifosfát (ADP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. ATP slouží jako buněčné energetické oběživo. GTP – guanosintrifosfát, makroergní nukleotid. Při hydrolýze na guanosidifosfát (GDP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. Má význam jak z hlediska energetiky enzymatických reakcí, tak i z hlediska buněčné signalizace pomocí specializovaných G-proteinů, které využívají změn v důsledku navázání GTP a hydrolýzy na GDP. Mikrotubuly – orientovaná přímá dutá vlákna tvořící součást opěrného a pohybového aparátu buňky. Dynamicky se vytvářejí i dekomponují. Vznikají polymerací bílkovin dvou typů, tubulinů. Polymerace i disociace na tubuliny probíhá jen z jednoho konce a je řízena hydrolýzou guanosintrifosfátu na guanosindifostát. Jsou také základem složitějších organel: centriolů, bazálních tělísek, řasinek či bičíků. Motorické proteiny – bílkoviny, které v buňkách realizují převod energie makroergních vazeb na mechanický pohyb. Kineziny – třída motorických proteinů v eukaryotických buňkách (buňkách obsahujících jádro a jiné organely oddělené membránami). Pomocí kráčivého pohybu po orientovaných lineárních trubicovitých mikrotubulech za hydrolýzy ATP realizují nitrobuněčné pohyby například při dělení buněk či transportu vakuol. |
Jelikož matka příroda si v živých organismech některé nanotechnologie oblíbila, začněme vyprávění o transportu pomocí kráčejících molekul pokorným studiem jednoho prokazatelně fungujícího mechanismu – pohybem kinezinů po mikrotubulech.
Mikrotubuly – buněčné nanochodníčky
Mikrotubuly jsou jednou ze složek cytoskeletuCytoskelet – buněčná kostra, opěrný a pohybový aparát buňky, dynamická struktura průběžně tvořená polymerací a rozkládaná disociací podle aktuálních potřeb. Buněčná kostra se skládá z vláken a tubulů. Její funkce je strukturní, ochranná i transportní.. Stavebními prvky mikrotubulu jsou bílkoviny α-tubulin a β-tubulin. Tubuliny α a β se slučují do heterodimeruHeterodimer – molekula složená ze dvou různých menších podjednotek, monomerů. Nejznámějším heterodimerem je sacharóza, řepný cukr.. Tyto dvojice tubulinů se do sebe zapojují a vytvářejí lineární vlákno se střídajícími se jednotkami α a β, tzv. protofilamentum. Mikrotubulus je dutá trubička o zevním průměru 25 nm, se stěnou z 13 protofilament. Protofilamenta jsou navzájem rovnoběžná, jsou však vůči sobě lehce posunuta, α i β tubuliny sousedících protofilament vytvářejí jeden závit šroubovice. Jeden konec mikrotubulu je označovaný (–) je zakončen pouze α-tubuliny a druhý, (+) konec pouze β-tubuliny, mikrotubulus je tudíž orientovaný útvar.
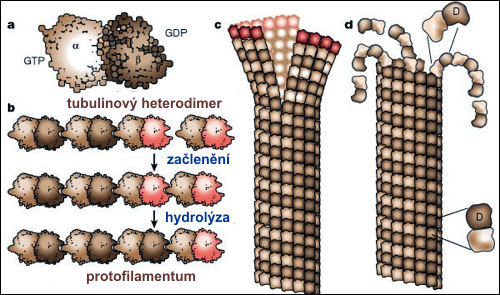
Struktura mikrotubulu: a) Heterodimer tubulinů α a β, zde je znázorněn β-tubulin s navázanou molekulou GDPGDP – guanositdifosfát, makroergní sloučenina, produkt hydrolýzy guanosintrifosfátu. Pomocí G-proteinů se účastní buněčné signalizace.. b) Protofilamentum vyrůstá díky začleňování heterodimerů: β-tubliln s navázaným GTPGTP – guanosintrifosfát, makroergní nukleotid. Při hydrolýze na guanosidifosfát (GDP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. Má význam jak z hlediska energetiky enzymatických reakcí, tak i z hlediska buněčné signalizace pomocí specializovaných G-proteinů, které využívají změn v důsledku navázání GTP a hydrolýzy na GDP. je zvýrazněn červeně, zatímco β-tubulin s navázanou molekulou GDP je zakreslen hnědě. c) rostoucí mikrotubulus je chráněn před depolymerizací čepičkou z β-tubulinů s navázanou molekulou GTP. d) Hydrolýza GTP na GDP na konci protofilament vede k depolymerizaci mikrotubulů. Zdroj: Nature 422, 753-758 (17 April 2003).
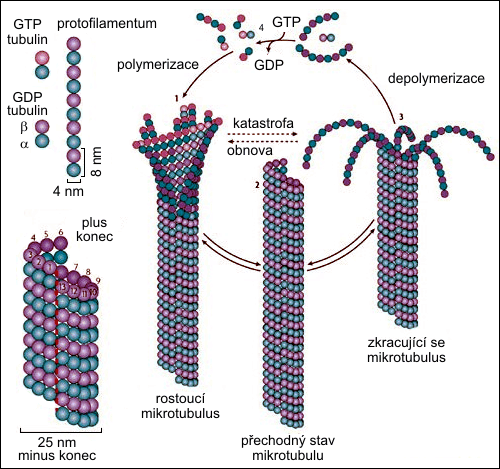
Struktura mikrotubulu. a) Stavební kameny mikrotubulu: Heterodimer sestávající z α- a β- tubulinu a protofilamentum. b) Šroubovice tvořená tubuliny je nedokonalá, stoupání šroubovice nedosahuje délky α-β dimeru. Červenou čárkovanou čarou je znázorněn šev, který na mikrotubulu vzniká. c) Životní cyklus mikrotubulu. Tubuliny, s navázaným GTP, tvořící ochrannou čepičku, jsou znázorněné růžově, Zdroj: Nature Reviews Molecular Cell Biology 9, 309–322 (April 2008).
Mikrotubulus roste pouze na (+) konci. Klíčovou roli při růstu či rozpadu mikrotubulu hraje přeměna GTPGTP – guanosintrifosfát, makroergní nukleotid. Při hydrolýze na guanosidifosfát (GDP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. Má význam jak z hlediska energetiky enzymatických reakcí, tak i z hlediska buněčné signalizace pomocí specializovaných G-proteinů, které využívají změn v důsledku navázání GTP a hydrolýzy na GDP. na GDPGDP – guanositdifosfát, makroergní sloučenina, produkt hydrolýzy guanosintrifosfátu. Pomocí G-proteinů se účastní buněčné signalizace.. Během polymerace je na α- i β-tubulin navázána molekula GTP. Zatímco vazba k α-tubulinu je stabilní, GTP navázané na β-tubulin může být časně po začlenění do mikrotubulu hydrolyzováno na GDP. Tak se mění i mechanické vlastnosti β-tubulinu – původně ohebná struktura s navázaným GTP se po hydrolýze na GDP mění na tuhou, díky čemuž rostou mikrotubuly rovně bez jakýchkoli ohnutí. Po odštěpení fosfátuFosfát – fosforečnan, v biochemii fosforečnanový anion ve vodném roztoku. z navázaného GTP má tubulin sklony k depolymerizaci, avšak pouze na konci vlákna. Mikrotubulus je před dekompozicí chráněn čepičkou tubulinů s navázaným GTP. Jakmile je na konci vlákna GTP hydrolyzováno, začne prudká depolymerizace. Toto přepnutí z růstu ke zkracování se označuje jako katastrofa. Osud mikrotubulu může zvrátit navázání nových stavebních tubulinů s GTP, které vytvoří novu ochranou čepičku. Zcela nové mikrotubuly začínají vyrůstat od (–) konce navázáním α-tubulinů na struktury souhrnně označované mikrotubulární organizační centra.

Model krátkého úseku mikrotubulu zobrazený
kryoelektronovou mikroskopií. .
(+) konec je směrem nahoru Zdroj: Wikipedie.
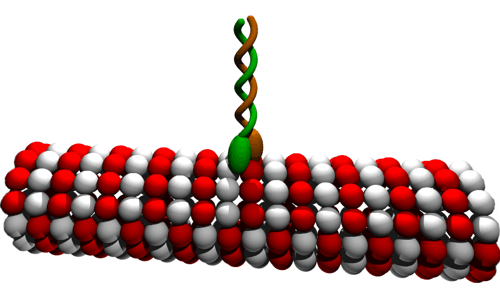
Schéma mikrotubulu. α- a β-tubuliny jsou znázorněny
bílými a červenými kuličkami.
Na vlákně je znázorněn zeleně a hnědě kinezin. Zdroj: Wikipedie.
Kineziny – nanoburlaci v buňce
KinezinyKineziny – třída motorických proteinů v eukaryotických buňkách (buňkách obsahujících jádro a jiné organely oddělené membránami). Pomocí kráčivého pohybu po orientovaných lineárních trubicovitých mikrotubulech za hydrolýzy ATP realizují nitrobuněčné pohyby například při dělení buněk či transportu vakuol. tvoří rodinu bílkovin, které se podílejí na pohybu uvnitř buněk. Kineziny jsou schopny se kráčivým pohybem přemisťovat podél mikrotubulu a díky připojení k jiným částem buňky zprostředkovat pohyb. Významnou roli hrají při dělení buněk a přemisťování dceřiné DNA v chromozómech do obou částí dělící se buňky, a spolu s ostatními motorickými proteiny se podílí na transportu velkých molekul, či změně tvaru buňky.
Tvar molekul kinezinů je variabilní, jen v savčích buňkách existuje alespoň několik desítek různých genů pro kineziny. Nejlépe je prozkoumaný kinezin I, jinak též konvenční kinezin. Je tvořený dvojicí lehkých a těžkých řetězců. Těžké řetězce jsou na svém N-konciKonce C a N – označení konců polypeptidů či bílkovin; C-konec je zakončen karboxylovou skupinou, N-konec aminoskupinou. uspořádány do klubíčka s ATPázovouATPázy – enzymy hydrolyzující adenosintrifosfát. Tento děj je zpravidla spřažen s energeticky náročným procesem. aktivitou – hlavičky kinezinu, která je vlastní motorickou jednotkou. Obsahuje vazebné místo jak pro molekulu ATP, tak pro navázání na tubuliny mikrotubulu.
Na hlavičku navazuje ohebný krček, který pokračuje do stopky, kde se oba těžké řetězce zavinují do alfa-šrouboviceAlfa helix – alfa šroubovice, typická sekundární struktura bílkovin. Pravotočivá šroubovice, jednotlivé závity jsou stabilizovány vodíkovými můstky., tím vytvářejí pevnou strukturu, která je však místy přerušena ohebnými pantovými oblastmi. C-konceKonce C a N – označení konců polypeptidů či bílkovin; C-konec je zakončen karboxylovou skupinou, N-konec aminoskupinou. těžkých řetězců vytvářejí spolu s lehkými řetězci ocas kinezinu. Lehké řetězce jsou orientovány stejně jako těžké řetězce, ke konci stopky se připojují k těžkým řetězcům svými N-konci a C-konce utvářejí vlastní ocas. Lehké řetězce obsahují několik oblastí označovaných jako TPRs, které zprostředkovávají interakci mezi dvěma proteiny. Tyto oblasti umožňuji ukotvení k objektu, který bude kinezin přepravovat. Rovněž oblasti na C-konci těžkého řetězce se mohou účastnit na připojování přepravovaného nákladu.

Schéma molekuly kinezinu. Vlevo jsou detailněji znázorněny hlavičky. Červeně je vyznačena molekula ATP. Stopka je zjednodušená, šroubovice je na několika místech přerušena ohebnými pantovými oblastmi.
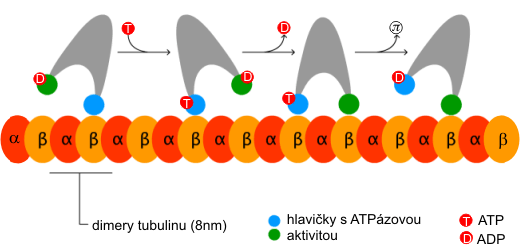
Schéma kráčení kinezinu po mikrotubulu v přiblížení
natáčející se vlásenky.
Zdroj: WIkipedie
Pohyb kinezinuKineziny – třída motorických proteinů v eukaryotických buňkách (buňkách obsahujících jádro a jiné organely oddělené membránami). Pomocí kráčivého pohybu po orientovaných lineárních trubicovitých mikrotubulech za hydrolýzy ATP realizují nitrobuněčné pohyby například při dělení buněk či transportu vakuol. po mikrotubuluMikrotubuly – orientovaná přímá dutá vlákna tvořící součást opěrného a pohybového aparátu buňky. Dynamicky se vytvářejí i dekomponují. Vznikají polymerací bílkovin dvou typů, tubulinů. Polymerace i disociace na tubuliny probíhá jen z jednoho konce a je řízena hydrolýzou guanosintrifosfátu na guanosindifostát. Jsou také základem složitějších organel: centriolů, bazálních tělísek, řasinek či bičíků. si v prvním přiblížení můžeme přestavit jako natáčející se vlásenku, která má na svém rozevřeném konci dvě hlavičky kinezinu. Tyto hlavičky nakračují na protofilamentum mikrotubulu v místech sousedních β-tubulinů, takže α-tubulin mezi nimi je překročen. Délka takového kroku je 8 nm. Hlavičky kinezinu mohou být ve třech stavech – bez nukleotiduNukleotidy – fosforylované nukleosidy, na pátý uhlík sacharidové složky je navázán jeden nebo více zbytků kyseliny fosforečné. Sacharidovou složku tvoří buď ribóza (ribonukleotidy) nebo deoxyribóza (deoxyribonukleotidy). Tvoří monomery nukleových kyselin, dále vstupují (přímo nebo ve formě derivátů) do enzymatických reakcí, přenosu energie a informace. Genetická informace je kódována posloupností nukleotidů. (stav 0), s ATPATP – adenosintrifosfát, nejznámější makroergní nukleotid. Při hydrolýze na adenosindifosfát (ADP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. ATP slouží jako buněčné energetické oběživo. (stav T) a s ADPADP – adenosindifosfát, makroergní nukleotid tvořený dusíkatou heterocyklickou bází adeninem navázanou na sacharid ribózu, na niž jsou zároveň navázány dva zřetězené zbytky kyseliny fosforečné. (stav D). Jak 0-hlavička bez nukleotidu, tak T-hlavička s navázaným ATP naléhají na β-tubulin, zatímco D-hlavička s navázaným ADP se nachází nad mikrotubulem. Navázání ATP na hlavičku (0-T) vede k otočení vlásenky volným koncem směrem k dalšímu vazebnému místu na mikrotubulu. Uvolnění ADP (D-0) způsobí nakročení hlavičky na protofilamentum mikrotubulu. Hydrolýza ATP na ADP (T-D) je následována uvolněním hlavičky z mikrotubulu. Pohyb se uskutečňuje podle schématu: D0-DT-0T-0D-TD-T0-D0. Pořadí hlaviček zůstává zachované bez ohledu na to, která je vpředu a která vzadu.
Skutečný pohyb hlaviček dosud není přesně znám. Modelování pohybu kinezinu ukázalo, že i u identických hlaviček, vázajících se na stejné protofilamentum mikrotubulu, nemůže být pohyb zcela symetrický a hlavičky se musí pohybovat po jiných drahách. Přesnější představou pohybu kinezinu (než pouhé natáčení celé molekuly) je kráčení hlaviček na ohebných krčcích, při kterém každá hlavička nakračuje jiným způsobem.
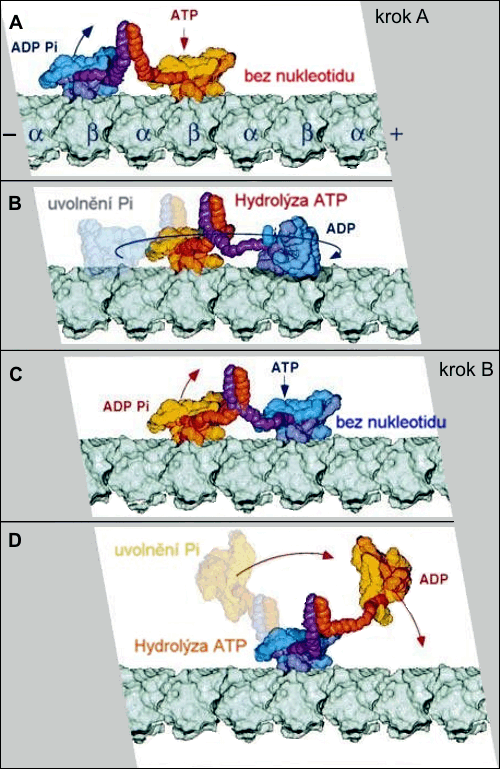
Schéma kráčivého pohybu hlaviček kinezinu po
mikrotubulu,
Zdroj:
J. Mol. Biol. (2000) 297, 1087–1103.
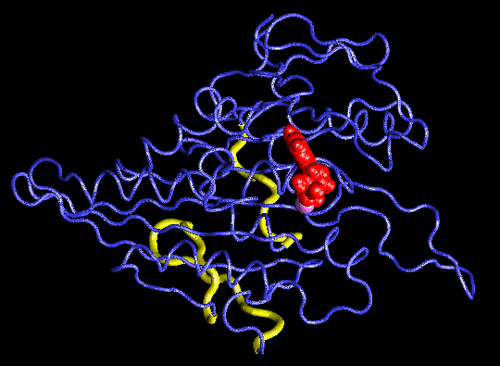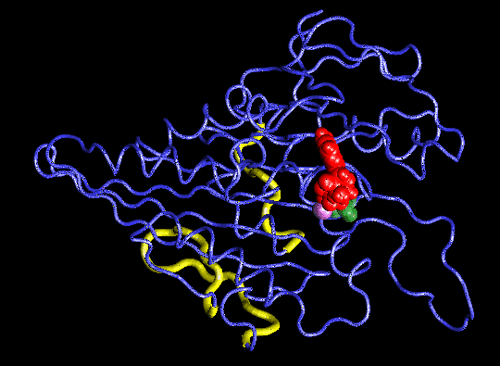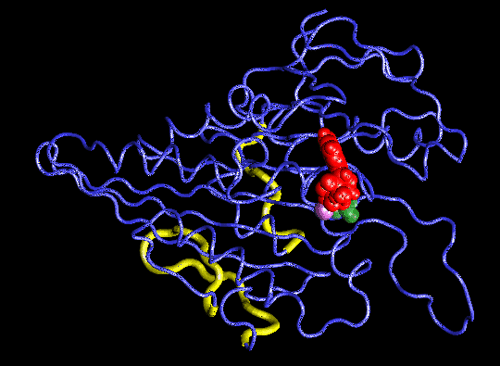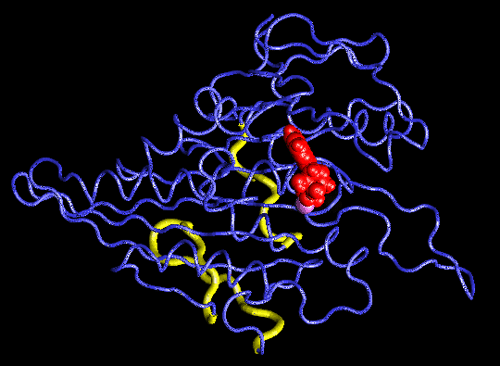
Konformační změna hlavičky kinezinu díky hydrolýze ATP na ADP vizualizovaná pomocí programu VMD. Fosforečnanový anion, který se při hydrolýze odštěpuje, je vyznačen na kuličkovém modelu ATP zelenou barvou. Zbylý ADP je znázorněn červeně. Fialově je znázorněn hořečnatý kation, který se rovněž podílí na změně uspořádání bílkoviny. Modrý hadicový model kinezinu je doplněn žlutými předpokládanými vazebnými místy na tubulinech. Zdroj: TCB University of Illinois at Urbana Champaign.
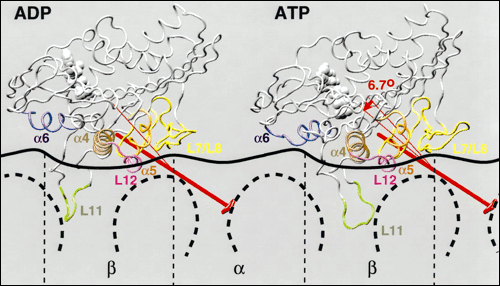
Konformační změny hlavičky kinezinu v závislosti na navázaném nukleotidu vizualizované pomocí programu VMD. Červenou šipkou je znázorněna osa otáčení. Zdroj: Biophysical Journal 75 (1998), 646-661
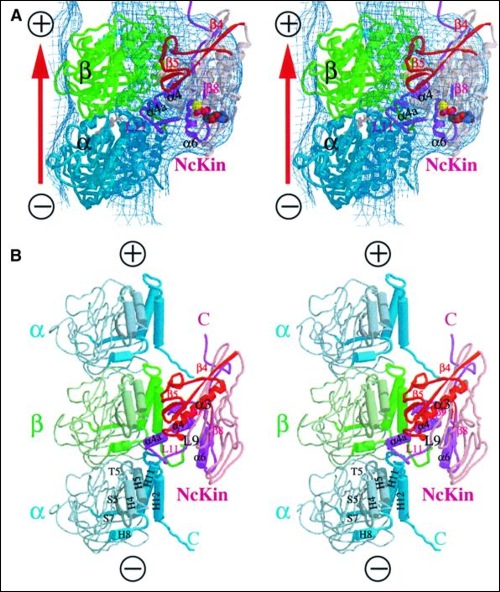
Struktura bílkovin a elektronové hustoty kinezinu na mikrotubulu ve stereoskopických dvojicích. Na snímku A je znázorněna vizualizace elektronové hustoty. β-tubulin je znázorněn zeleně, α-tubulin je modrý, struktury kinezinu jsou znázorněny červeně, šedě a fialově. Červená šipka ukazuje směr pohybu kinezinu od (–) konce k (+) konci mikrotubulu. Kuličkovým modelem je ukázána molekula ADPADP – adenosindifosfát, makroergní nukleotid tvořený dusíkatou heterocyklickou bází adeninem navázanou na sacharid ribózu, na niž jsou zároveň navázány dva zřetězené zbytky kyseliny fosforečné.: fosfor zeleně, uhlík černě, kyslík červeně a dusík modře, vodíkové atomy nejsou znázorňovány. Interagující elektrony jsou rozloženy především nad β-tubulinem, ale přesahují i k sousedním tubulinům, zejména sousedům na témže protofilamentu. Na snímku B je vyznačena sekundární struktura bílkovinSekundární struktura bílkovin – prostorové uspořádání polypeptidového řetězce bílkoviny díky vzájemné interakci částí řetězce. Nejznámější útvary jsou alfa šroubovice, beta skládaný list či beta vlásenka.. Šroubovice jsou znázorněny válečky, beta struktury jsou naznačeny provazci. Zvýrazněny jsou C-konce bílkovin. Zde znázorněný kinezin NcKin se nachází v plísni Neurospora crassaNeurospora crassa – červená chlebová plíseň, modelový organismus. E. Tatum a G. W. Beadle na ní prokázali díky mutacím způsobeným rentgenovým zářením, že jeden gen odpovídá jednomu enzymu, za což v roce 1958 dostali Nobelovu cenu za fyziologii a medicínu. Genom N. crassa je plně sekvenován. Jako modelový organismus je studován v souvislosti s cirkadiálními rytmy, epigenetickou, umlčováním genů, buněčnou polaritou či splýváním buněk.. Zdroj: EMBO J. 20/22 (2001), 6213–6225
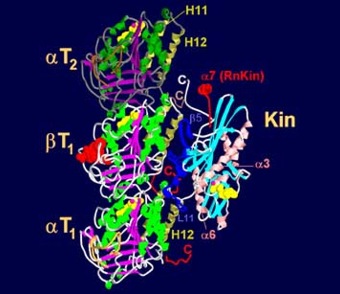
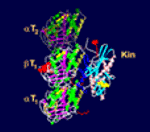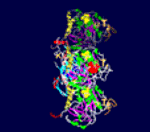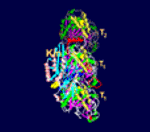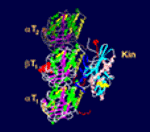
Model interakce mikrotubulu a kinezinu RnKin z mozku
potkana.
Zdroj:
MPASMB-Hamburg.
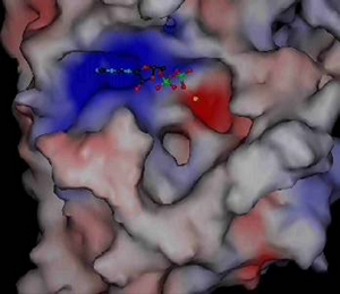
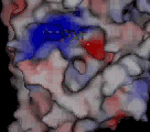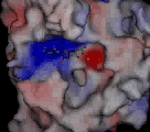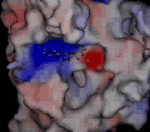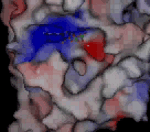
Molekula ADP ve vazebném místě kinezinu NcKin plísně Neurospora crassaNeurospora crassa – červená chlebová plíseň, modelový organismus. E. Tatum a G. W. Beadle na ní prokázali díky mutacím způsobeným rentgenovým zářením, že jeden gen odpovídá jednomu enzymu, za což v roce 1958 dostali Nobelovu cenu za fyziologii a medicínu. Genom N. crassa je plně sekvenován. Jako modelový organismus je studován v souvislosti s cirkadiálními rytmy, epigenetickou, umlčováním genů, buněčnou polaritou či splýváním buněk.. Kladně nabité oblasti jsou znázorněny červeně, záporně modře. Růžově je znázorněn hořečnatý kation. Nabité oblasti jsou dány konkrétními aminokyselinami, které tvoří bílkovinuBílkoviny – proteiny, vysokomolekulární biopolymery aminokyselin s molekulovou hmotností tisíc až milión. Tvoří strukturální i funkční podstatu živé hmoty. kinezinu. Díky jejich kyselé či zásadité reakci buď odštěpují proton a vytvářejí záporně nabitou oblast, nebo naopak proton navazují a vytvářejí kladně nabitou oblast. V ATPATP – adenosintrifosfát, nejznámější makroergní nukleotid. Při hydrolýze na adenosindifosfát (ADP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. ATP slouží jako buněčné energetické oběživo. je heterocyklickáHeterocyklické sloučeniny – organické sloučeniny vytvářející cyklické struktury, ve kterých jsou do kruhu vázány nejen atomy uhlíku, ale i jiné atomy, nejčastěji kyslík, dusík nebo síra. Nejstabilnější a nejvýznamnější jsou pěti a šestičlenné heterocyklické sloučeniny. Cyklus v molekule může být jeden, časté jsou i sloučeniny s více cykly, které většinou sdílejí část atomů v sousedících cyklech (kondenzované cykly). báze adenin bohatá na dusíkDusík – Nitrogenium, plynný chemický prvek tvořící hlavní složku zemské atmosféry. Patří mezi biogenní prvky, které jsou základními stavebními kameny živé hmoty. Tento plyn popsal jako první Němec Carl Wilhelm Scheele v roce 1777. Poté co bylo zjištěno, že je kyselina dusičná odvozena od dusíku, pro něj Chaptal navrhl název nitrogéne, což znamená ledkotvorný, který se udržel v latinském označení nitrogenium.; má tendenci ve vodném prostředí na sebe vázat vodíkVodík – Hydrogenium, je nejlehčí a nejjednodušší plynný chemický prvek, tvořící převážnou část hmoty ve vesmíru. Má široké praktické využití jako zdroj energie, redukční činidlo při chemické syntéze a v metalurgii nebo jako náplň balonů a vzducholodí. Vodík objevil roku 1766 Henry Cavendish. ve formě kationtu a nabíjí se tak kladně, fosforečnanové skupiny, ležící na opačné straně molekuly ATP jej naopak odštěpují a jsou nabité záporně. Rozložení povrchového náboje bílkoviny zajišťuje jak samotné navázání ATP do přesného umístění na hlavičce kinezinu, tak i potřebnou orientaci molekuly ATP. Odštěpený fosforečnanový anion si s sebou odnáší záporný náboj, díky tomu se lokálně mění elektrické pole, což následně vede ke změně uspořádání bílkoviny i ve vzdálenějších oblastech. K těmto změnám přispívá svým nábojem i hořečnatý anion Mg2+, který se na své vazebné místo dostává iontovým filtrem tvořeným lokálním elektrostatickým polem povrchu bílkoviny a nabitého konce nukleotiduNukleotidy – fosforylované nukleosidy, na pátý uhlík sacharidové složky je navázán jeden nebo více zbytků kyseliny fosforečné. Sacharidovou složku tvoří buď ribóza (ribonukleotidy) nebo deoxyribóza (deoxyribonukleotidy). Tvoří monomery nukleových kyselin, dále vstupují (přímo nebo ve formě derivátů) do enzymatických reakcí, přenosu energie a informace. Genetická informace je kódována posloupností nukleotidů.. Zdroj: MPASMB-Hamburg.
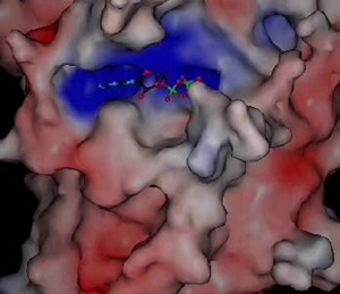
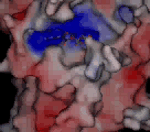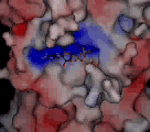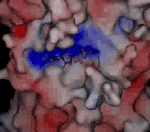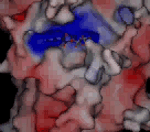
Odlišnosti ve struktuře kinezinů. V tomto případě je znázorněna molekula ADP ve vazebném místě kinezinu Kar3 kvasinky Saccharomyces cerevisiaeSaccharomyces cerevisiae – pivovarská kvasinka, modelový organismus. První eukaryotní organismus, u kterého byla určena sekvence nukleotidů v DNA.. Kladně nabité oblasti jsou znázorněny červeně, záporně modře. Vazebné místo pro růžově znázorněný hořečnatý kation se u tohoto kinezinu odhalí až po naklonění na animaci vpravo. Zdroj: MPASMB-Hamburg
Většina kinezinůKineziny – třída motorických proteinů v eukaryotických buňkách (buňkách obsahujících jádro a jiné organely oddělené membránami). Pomocí kráčivého pohybu po orientovaných lineárních trubicovitých mikrotubulech za hydrolýzy ATP realizují nitrobuněčné pohyby například při dělení buněk či transportu vakuol. se pohybuje po mikrotubuluMikrotubuly – orientovaná přímá dutá vlákna tvořící součást opěrného a pohybového aparátu buňky. Dynamicky se vytvářejí i dekomponují. Vznikají polymerací bílkovin dvou typů, tubulinů. Polymerace i disociace na tubuliny probíhá jen z jednoho konce a je řízena hydrolýzou guanosintrifosfátu na guanosindifostát. Jsou také základem složitějších organel: centriolů, bazálních tělísek, řasinek či bičíků. ve směru od (–) konce k (+) konci, což odpovídá pohybu nákladu od centra buňky k periferii, avšak existují i kineziny pohybující se v opačném směru. Dokonce i orientace bílkovinyBílkoviny – proteiny, vysokomolekulární biopolymery aminokyselin s molekulovou hmotností tisíc až milión. Tvoří strukturální i funkční podstatu živé hmoty. těžkého řetězce může být obrácená a hlavička je tvořena na C-konciKonce C a N – označení konců polypeptidů či bílkovin; C-konec je zakončen karboxylovou skupinou, N-konec aminoskupinou.. V případě, kdy kinezin není připojen k nákladu, pantová místa stopky chrání buňku před spotřebováváním ATPATP – adenosintrifosfát, nejznámější makroergní nukleotid. Při hydrolýze na adenosindifosfát (ADP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. ATP slouží jako buněčné energetické oběživo. naprázdno sbalením stopky směrem k hlavičkám, v důsledku čehož se ATPázováATPázy – enzymy hydrolyzující adenosintrifosfát. Tento děj je zpravidla spřažen s energeticky náročným procesem. aktivita hlaviček sníží.
Závěr
Kráčející molekuly představují perspektivní transportní mechanismus na molekulární úrovni. Vedle uměle vytvořených molekul si pozornost zaslouží i motorické proteiny, jak v přirozené podobě, tak i případně po genetických úpravách. Samoorganizující se mikrotubuly mohou v požadovaném místě narůstat v přímém směru. V případě potřeby mohou být naopak disociovány jak omezením GTPGTP – guanosintrifosfát, makroergní nukleotid. Při hydrolýze na guanosidifosfát (GDP) a fosforečnanový anion se uvolňuje energie použitelná pro spřažené chemické reakce. Má význam jak z hlediska energetiky enzymatických reakcí, tak i z hlediska buněčné signalizace pomocí specializovaných G-proteinů, které využívají změn v důsledku navázání GTP a hydrolýzy na GDP., tak působením speciálních bílkovin – proteinů spouštějících katastrofu (katastrofinů). Pomocí látek, které jsou v současné době používány jako protinádorové léky, je možné mikrotubuly buď stabilizovat pomocí paclitaxelu získávaného z tichomořského tisu, nebo naopak depolymerizovat například pomocí kolchicinu získávaného z ocúnu jesenního. Intenzivní výzkum genetiky a molekulární biologie kinezinů může vedle pochopení nitrobuněčných mechanismů přinést i poznatky využitelné v nanotechnologiích, ať přímo nebo jako vzor pro umělé struktury. Další zajímavou oblastí aplikací kinezinů je nanoterapie, kde jsou využitelné jako robotická zařízení, ať přirozeně přítomná v buňce nebo zanášená z vnějšku, pro terapii lokalizovanou na úroveň jednotlivých cílových buněk, či dokonce nitrobuněčných struktur.
Klip týdne: Pohyb kinezinu po mikrotubulu
Pohyb kinezinu po mikrotubulu. Protofilamenum – vlákno buněčné organely mikrotubulu – je polymer tvořený periodicky se opakujícími bílkovinami α-tubulinen (bíle) a β-tubulinen (zeleně). Po této struktuře se kráčivým pohybem přesouvá v jednom směru molekula kinezinu, která za sebou může vléci náklad – další buněčné struktury, připojené k ocasu kinezinu na konci stopky (stopka naznačena šedě). Připojení a uvolnění hlaviček kinezinu (modře) v místě β-tubulinu se uskutečňuje díky rozkladu molekuly adenosintrifosfátu (ATP) na adenosidifosfát (ADT). V druhé části je naznačený samotný pohyb. Povšimněte si, že pohyb není zcela symetrický: Hlavičky kinezinu totiž nejsou na rozdíl od končetin zrcadlově symetrické a začátek stopky, který se při pohybu částečně rozvíjí, je tvořený pravotočivou šroubovicí. Tato asymetrie napomáhá jednosměrnému pohybu. Pohyb podložky – mikrotubulu – zprostředkovaný kinezinem znázorněný v druhé části se realizuje v případě, kdy jsou na sebe ocasy protisměrně zapojeny dva kineziny připojené hlavičkami na opačně orientovaných mikrotubulech. Zajišťují tak namísto přemisťování nákladů vzájemný klouzavý pohyb mikrotubulů. Zdroj: YouTube 2007. (avi/xvid, 4 MB)
Literatura

