|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Nízkoteplotná plazma VIII – Chémia plazmy
Vladimír Scholtz, Josef Khun
Vďaka bohatej škále zrážkových procesov v plazme, ktoré boli popísané v prechádzajúcich bulletinoch [1, 2 a 3], nastáva v plazme čulý ruch. Následkom toho tu dochádza k rôznym chemickým reakciám a vzniku rôznych reaktívnych i stabilných látok. V tomto bulletine popíšeme najčastejšie chemické procesy a generované látky v plazme elektrických výbojov vo vzduchu.
|
Plazma – kvazineutrální soubor nabitých a neutrálních částic, který vykazuje kolektivní chování. Lidsky to znamená, že se v dané látce nachází elektricky nabité částice. Kladné a záporné náboje se navzájem kompenzují, takže celek je elektricky neutrální. Částice jsou schopné reagovat na elektrická a magnetická pole jako celek. Plazma vzniká odtržením elektronů z elektrického obalu atomárního plynu nebo ionizací molekul. S plazmatem se můžeme setkat v elektrických výbojích (blesky, jiskry, zářivky), v polárních zářích, ve hvězdách, ve slunečním větru a v mlhovinách. Pro plazma jsou typické silně nelineární jevy a nestability. Přes 99 % atomární látky ve vesmíru je v plazmatickém skupenství. Střední volná dráha – průměrná vzdálenost mezi srážkami. V plazmatu, kde dochází jen k odklonu nabité částice z původního směru vlivem elektrických sil, chápeme střední volnou dráhu jako takovou vzdálenost, na které se částice v průměru odchýlí od původního směru o 90°. Radikál – částice, které mají ve svém vnějším orbitalu alespoň jeden nepárový elektron, tj. elektron který nemá vykompenzován svůj spin jiným elektronem opačného spinu ve stejném orbitalu. Vyznačují se velkou reaktivitou, a proto také krátkou dobou života. Výrazně ovlivňují složení plazmatu. Volné radikály označujeme v reakcích tečkou umístěnou v pravém horním indexu příslušné částice. Typickými radikály vyskytujícími se v nízkoteplotním plazmatu jsou například hydroxylový radikál OH• nebo peroxydový radikál HO2•. Naopak radikály nejsou například peroxid vodíku H2O2, ozón O3 ani singletový kyslík 1O2 – vyznačují se sice velkou reaktivitou, ale nemají nepárový elektron. I navzdory poměrně jasné definici nepanuje v chemii úplná shoda v názorech, které částice jsou a které nejsou radikály. |
Suchý vzduch sa skladá z 78 % (objemových) dusíkuDusík – Nitrogenium, plynný chemický prvek tvořící hlavní složku zemské atmosféry. Patří mezi biogenní prvky, které jsou základními stavebními kameny živé hmoty. Tento plyn popsal jako první Němec Carl Wilhelm Scheele v roce 1777. Poté co bylo zjištěno, že je kyselina dusičná odvozena od dusíku, pro něj Chaptal navrhl název nitrogéne, což znamená ledkotvorný, který se udržel v latinském označení nitrogenium., z 21 % kyslíkuKyslík – Oxygenium, plynný chemický prvek, tvoří druhou hlavní složku zemské atmosféry. Je biogenním prvkem a jeho přítomnost je nezbytná pro existenci většiny živých organizmů na naší planetě. V atmosféře tvoří plynný kyslík 21 objemových %. Kromě obvyklých dvouatomových molekul O2 se kyslík vyskytuje i ve formě tříatomové molekuly jako ozon O3. Produkty hoření se nazývají oxidy, dříve kysličníky. Kyslík je třetím nejhojnějším prvkem ve vesmíru. a iba zostávajúce 1 % zaberajú ostatné plyny ako argónArgon – prvek patřící mezi vzácné plyny, které tvoří necelé 1 % zemské atmosféry. Jde o nereaktivní bezbarvý plyn bez chuti a zápachu. Objev argonu je oficiálně připisován lordu Rayleighovi a Williamu Ramsayovi, kteří ho detekovali roku 1894. Jako inertní atmosféra se využívá v metalurgii, při balení potravin, v plazmových technologiích i ve výbojkách., oxid uhličitý, neónNeon – plynný chemický prvek, patřící mezi vzácné plyny. Nevytváří sloučeniny. Neon byl objeven v roce 1898 Williamem Ramsayem a Morrisem Traversem. Využívá se v osvětlovacích tělesech a světelných indikátorech. Slouží jako náplň do některých typů laserů., héliumHelium – plynný chemický prvek, patřící mezi vzácné plyny a tvořící druhou nejvíce zastoupenou složku vesmírné hmoty. Bezbarvý plyn, bez chuti a zápachu, chemicky zcela inertní. Francouzský astronom Pierre Janssen objevil helium ze spektrální analýzy sluneční korony. V roce 1895 se britskému chemikovi Williamu Ramsayovi podařilo izolovat plynné helium na Zemi. Je pojmenované po starořeckém bohu Slunce, Héliovi. atď. V závislosti na podmienkach sa vo vzduchu ešte obvykle nachádzajú vodné pary, pri bežných teplotách 20÷30 °C v množstve až do 20 g/m3. Z toho vyplýva, že chemické reakcie budú prebiehať najmä medzi dusíkom, kyslíkom a vodnou parou a práve aktívne formy týchto látok budú mať v chémii plazmy a jej interakcii s okolím rozhodujúcu úlohu. V takomto prostredí vznikajú, okrem iných, rôzne aktívne častice, ktoré sa súhrnne nazývajú ako reaktívne kyslíkové častice (ROS – Reactive Oxygen Species) a reaktívne dusíkové častice (RNS – Reactive Nitrogen Species).
Reaktívne kyslíkové častice
Najčastejšie reaktívne kyslíkové častice sú atomárny kyslík O, singletový kyslík 1O2, ozón O3, superoxidový anión O2•−, hydroxylový radikál OH•, hydroxylový anión OH−, peroxidový radikál HO2• alebo peroxid vodíku H2O2. Niektoré z nich si popíšeme bližšie.
|
Atomárny kyslík O je vysoko reaktívny a rýchlo oxiduje okolité materiály alebo reaguje s ostatnými molekulami kyslíku. Pri elektrických výbojoch vzniká pri zrážkach energetických iónov alebo elektrónov s molekulami kyslíku alebo pri rozpade ozónu. Bežne sa nachádza v stratosféreStratosféra – vrstva atmosféry nad troposférou. Sahá přibližně do 50 km. Součástí stratosféry je ozónová vrstva, která pohlcuje škodlivé ultrafialové záření přicházející ze Slunce. Ve stratosféře nedochází k turbulentnímu proudění, neboť teplota vzduchu s výškou roste (růst způsobuje pohlcování UV záření). pri štiepení ozónu. Singletový kyslík 1O2 je molekula kyslíku v elektrónovo excitovanom stave, v ktorom sú všetky spinySpin – vlastní (vnitřní) rotační moment částice souvisící s Lorentzovou symetrií. Pro částici v centrálním poli se přirozeným způsobem skládá s momentem hybnosti. Částice s nenulovým spinem se mohou chovat jako elementární magnetické dipóly μ, aniž by měly elektrický náboj. Takové částice reagují na vnější magnetická pole. elektrónov spárované. Bežná molekula kyslíku, tzv. tripletový kyslík 3O2, má totiž v dvojici najvyšších väzobných orbitálov dva elektróny s rovnakým spinom, čo do istej miery znižuje jeho reaktivitu. Väčšina látok má v základnom stave všetky párové elektróny podľa spinu spárované a na reakciu s tripletovým kyslíkom je potrebná vysoká aktivačná energia. Preto musíme väčšinu horľavých látok na vzduchu podpaľovať. Ak by bola bežná molekula kyslíku realizovaná singletovým kyslíkom, bola by všetka organická hmota v prítomnosti vzdušného kyslíku veľmi rýchlo oxidovaná na CO2 a vodu. Ozón O3 je alotropická modifikácia kyslíku, je možné ho generovať elektrickým výbojom v plynoch obsahujúcich kyslík O2. Ozón je silné oxidačné činidlo a vo väčších koncentráciách je pre živé organizmy jedovatý. Prirodzene sa vyskytuje v stratosfére asi 15 až 50 km nad Zemou v koncentrácii 1 až 100 ppm alebo vzniká fotochemickou cestou pri reakcii oxidov dusíku s organickými zlúčeninami a najmä v horúcich letných dňoch tvorí súčasť smogu, sú ním povestné napríklad Atény. Superoxidový anión O2•− je molekulový radikál kyslíku s pridaným elektrónom. Sám o sebe nie je príliš reaktívny, môže však reagovať s inými atómami a molekulami za vzniku podstatne reaktívnejších látok. Pri reakcii dvoch superoxidových aniónov a vodíku môže vzniknúť peroxid vodíku. Hydroxylový radikál OH• je vysoko reaktívna častica, ktorá bezprostredne ohrozuje živé bunky. |
Reaktívne dusíkové častice
Najčastejšie reaktívne dusíkové častice sú atomárny dusík N, excitovaný atomárny dusík N*, elektrónovo excitovaná molekula dusíku N2*, vibračne excitovaná molekula dusíku N2(ν) alebo oxid dusnatý NO a ďalšie oxidy dusíku NOx.
Chemické reakcie vo vlhkom vzduchu
Konkrétnych reakcií, ktoré generujú uvedené častice, môže byť v elektrickom výboji vo vzduchu až niekoľko stoviek, viď napr. [4]. Z nich uvedieme tie najvýznamnejšie. Nasledujúci zoznam reakcií nie je úplný ani uzatvorený, má predstavovať najčastejšie reakcie prebiehajúce pri elektrických výbojoch vo vlhkom vzduchu. Reakcie uvádzame podľa zrážkových dejov popísaných v predchádzajúcich dieloch.
|
Fotodisociácia Pokiaľ je v plazme generované ultrafialové žiarenie, môže dopadom dostatočne energetického fotónu s energiou hν na molekulu dôjsť k jej disociácii: O2 + hν → O* + O* Ionizácia Základom vzniku plazmy je ionizácia pri zrážke rýchleho elektrónu s neutrálnou molekulou, ktorá je spojená so vznikom páru kladný ión – elektrón: e + N2
→ N2+ + e + e Záchyt elektrónu a disociácia Pri zrážke elektrónu s neutrálnou molekulou dochádza k zachyteniu elektrónu na molekule, prípadne aj k jej disociácii:
e + O2 → O2•− Rekombinácia Pokiaľ sa kladný ión stretne s elektrónom, dochádza najčastejšie k rekombinácii a disociácii iónu:
e + N2+ → N* + N Disociácia bez záchytu elektrónu Pri zrážke elektrónu s neutrálnou molekulou môže dôjsť k jej disociácii aj bez zachytenia elektrónu:
e + O2 → O + O + e Rekombinácia a výmena nábojov Pri zrážke iónu s iným iónom alebo neutrálnou molekulou dochádza k rekombinácii alebo výmene náboja: N2+ +
O2− → N2 + O2 Excitácia Zrážkou elektrónu s neutrálnou molekulou nemusí dôjsť k jeho zachyteniu, ale odovzdaním časti energie dochádza ku vzniku radikálov alebo excitovaných foriem molekúl (M* označuje excitáciu preskokom elektrónu na vyššiu hladinu, M(ν) označuje excitáciu rozkmitaním molekuly, tzv. vibračnú excitáciu):
e + N2 → N2(v) + e Ďalšie reakcie Ďalšie látky často vznikajú už iba chemickými reakciami neutrálnych alebo excitovaných molekúl bez priamej účasti elektrického výboja. Disociáciou molekuly kyslíku O2 vzniká atomárny kyslík O, ktorý spúšťa mechanizmus produkcie ozónu O3. O + O2 + M → O3 + M
(N2, O2) V prítomnosti vody vznikajú ďalšie ROS až po peroxid vodíka H2O2.
O* + H2O → OH• + OH• Disociáciou molekuly dusíku vzniká atomárny či excitovaný dusík N či N*, ktorý spúšťa mechanizmus produkcie oxidov dusíka a katalyzuje rozklad ozónu O3.
N* + O2 → NO + O |
Chemické reakcie v iných plynoch
Ako zdroj nízkoteplotnej plazmy sa často používajú aj rôzne elektrické výboje horiace v atmosfére bohatej na hélium alebo argón, v tom prípade je potrebné vziať do úvahy aj tieto plyny:
|
Hélium e + He → He+ +
e + e Argon e + Ar → Ar+ +
e + e |
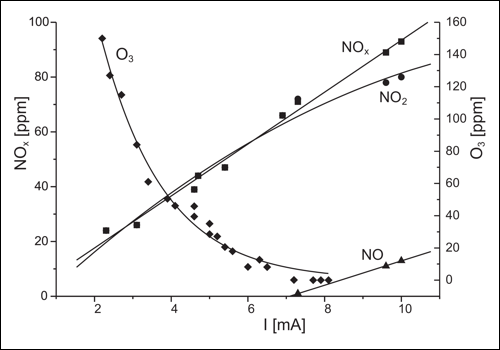
Uvedené reakcie prebiehajú rôznymi rýchlosťami. Konkrétne rýchlosti závisia na použitom type výboja, parametroch výboja, teplote a mnohých ďalších vplyvoch, ktoré je potrebné hľadať v odborných prácach a v tomto prehľade sa s nimi nebudeme zaoberať. Na ilustráciu uvedieme závislosť koncentrácie generovaných oxidov dusíku a ozónu na prúde v zápornom korónovom výboji v prúdiacom vzduchu.
Obr. 1. Závislosť koncentrácie generovaných oxidov dusíku a ozónu na prúde v zápornom korónovom výboji v prúdiacom vzduchu. So zvyšujúcim sa prúdom a teda intenzitou výboja sa zvyšuje produkcia oxidov dusíka, ktoré katalyzujú rozklad ozónu. Jav sa nazýva otrávenie výboja. Prevzaté z [5].
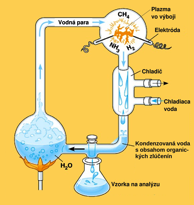
Príkladom vzniku nových zlúčením v plazme môže byť Miller-Ureyho experiment roku 1953, ktorým sa Stanley Miller a Harold Urey pokúšali napodobniť vznik života v podmienkach panujúcich na Zemi pred zhruba 4,5 miliardami rokov. Táto teória vzniku života sa v súčasnosti považuje za prekonanú, stále však slúži ako ukážka možností chémie plazmy. V experimente sa odparuje voda do atmosféry obsahujúcej metán CH4, vodík H2 a čpavok NH4. V atmosfére horí elektrický výboj generujúci plazmu zodpovednú za ďalšie chemické reakcie. Voda v atmosfére následne kondenzuje a celý cyklus sa opakuje. Po čase sa v tomto systéme objavia rôzne aminokyseliny a ďalšie organické zlúčeniny. Hlavným nedostatkom tejto teórie o vzniku života je fakt, že celý proces vzniku organických molekúl sa deje v smere nárastu entrópieEntropie – v termodynamice je definována vztahem dS = dQ/T, kde dQ je diferenciál tepla a T je absolutní teplota (1/T je integrační faktor). Takto zavedená entropie je na rozdíl od tepla úplným diferenciálem, její integrál nezávisí na cestě ve stavovém prostoru. Ve statistice má entropie význam logaritmické míry pravděpodobnosti realizace stavu, v kvantové teorii je logaritmickou mírou počtu kvantových stavů, kterými lze daný makroskopický stav realizovat. Entropie tak souvisí s „množstvím chaosu“ v systému. V informatice entropie popisuje množství informací. V uzavřeném systému může entropie jen růst. V termodynamické rovnováze dosáhne svého maxima., pre vznik života je ale, okrem vzniku organických molekúl, potrebná aj ich vysoká organizovanosť a teda zníženie entrópie.
Obr. 2: Schématické znázornenie Miller-Ureyho experimentu a fotografia
aparatúry.
Prevzaté z [6].
Video: Miller-Ureyho experiment.
Odkazy
- J. Khun, V. Scholtz: Nízkoteplotní plazma V: Srážky v plazmatu.; AB 47/2012
- J. Khun, V. Scholtz: Nízkoteplotní plazma VI – srážky v plazmatu; AB 4/2013
- J. Khun, V. Scholtz: Nízkoteplotní plazma VII – srážky v plazmatu III; Aldebaran Bulletin 08/2013
- I. A. Kossyi, A. Y. Kostinsky, A. A. Matveyev, and V. P. Silakov: Kinetic scheme of the non-equilibrium discharge in nitrogen-oxygen mixtures; Plasma Sources Sci. Technol 1 (1992) 207
- S. Pekárek, J. Rosenkranz: Ozone and nitrogen oxides generation in gas flow enhanced hollow needle to plate electrical discharge in air; Ozone Sc. & Eng. 24 (2002) 221-226
- TOK Resource: Origin of life on Earth