|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Od pralátky k zobrazování molekulárních orbitalů
Stanislav Poddaný
Otázkou složení hmoty se lidstvo zabývá již několik století, ale teprve v posledních desetiletích je možné se na základní kameny světa podívat přímo. Ještě nedávno nebylo možné zobrazit atomy ani jako celek. Dnes již s použitím femtosekundových laserů můžeme „nahlédnout“ přímo na jednotlivé vrstvy atomového obalu.
|
Řádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem. Mikroskop atomárních sil – AFM (Atomic Force Microscope). Zařízení skenuje povrch materiálu pomocí hrotu zavěšeného na pružném výkyvném raménku. Hrot je přitahován elektrostatickými a van der Waalsovými silami. Výkyvy raménka nad povrchem jsou sledovány laserem. AFM mikroskop není omezen na vodivé materiály jako STM mikroskop. AFM mikroskop byl vynalezen v roce 1986 G. Binnigem, C. Quatem a C. Gerberem. |
Řečtí filosofové, Demokritos z Abdéru (asi 460 – 370 př. n. l.) a Leukipos z Milétu (asi 500 – 440 př. n. l.), se domnívali, že veškerá hmota se skládá z drobných nepatrných dále již nedělitelných částeček – atomů. Tato převratná představa o povaze hmoty ale nebyla přijata všemi filozofy. Mezi těmi, kteří novou atomistickou teorii zavrhovali, byl i tehdy nejuznávanější řecký filosof Aristoteles (384 – 322 př. n. l.). V období středověku pak bylo jedinou uznávanou pravdou to, co bylo napsáno v Bibli nebo to, co učil Aristoteles. V důsledku toho upadla atomistická teorie v zapomnění.
S oživením myšlenky atomu přišel až v roce 1808 anglický chemik John Dalton (1766 – 1844), když pomocí atomů vysvětlil existenci chemických prvků. Podle Daltona jsou atomy téhož chemického prvku stejné a liší se od jiných prvků. Při chemickém slučování dochází ke sdružování vždy celistvého počtu atomů daných prvků, z nichž se sloučenina skládá. Dalton tedy stále ještě uvažoval o atomech jako o dále nedělitelných částicích. To, že takovýto model nebude přesný, ukázaly následné objevy. V roce 1833 anglický fyzik Michael Faraday (1791 – 1867) objevil zákony elektrolýzy, v roce 1895 díky Wilhelmu Conradu Roentgenovi (1845 – 1923) lidstvo poznalo RTG záření. O rok později Henri Becquerel (1852 – 1908) objevil radioaktivitu prvků. V tento okamžik už byla Daltonova představa nedělitelného atomu neudržitelná.
V roce 1897 anglický fyzik Joseph John Thomson (1856 – 1940) při zkoumání katodového paprsku, který vyzařuje rozžhavený kov v silném elektrickém poli, objevil novou částici – elektron. Spočítal jeho hmotnost a náboj. Hmotnost elektronu vycházela tisíckrát menší než atom vodíku, který byl doposavad považován za nejmenší částicí hmoty. Záporný náboj částice a neutralita atomu dále ukazovaly na to, že musí existovat ještě další dosud neobjevená částice. Po svém objevu se Thomson pokusil opravit dosavadní představu o složení hmoty. Svůj model atomu Thomson sám přirovnával k pudinku s rozmíchanými rozinkami. Představoval si, že atom je kladně nabitá koule, uvnitř které jsou rovnoměrně rozptýleny záporně nabité elektrony. Počet elektronů je takový, že kladné a záporné náboje se navzájem ruší a atom se navenek chová jako elektricky neutrální.
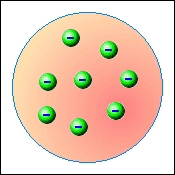
Pudinkový model neměl dlouhé trvání. Již v roce 1911 Ernest Rutherford (1871 – 1937) ostřelováním zlaté fólie jádry helia tento model vyvrátil. Pokud by měla být Thomsova představa správná, naměřil by Rutherford heliová jádra rovnoměrně rozptýlená, jako po odrazu od pevné kuličky. Výsledek experimentu byl ale v přímém rozporu s Thomsovým modelem. Většina jader procházela fólií beze změny, několik z nich bylo odchýleno od původního směru. Pouze u několika jader helia došlo k odrazu jako od pevné koule. Na základě výsledku experimentu Rutherford formuloval svůj planetární model atomu. Malou oblast (10−15÷10−14 m) s kladným nábojem, od kterého se jádra helia odrážela, nazval jádrem atomu. Obal jádra si pak Rutherford představoval jako oblast kruhových drah elektronů.
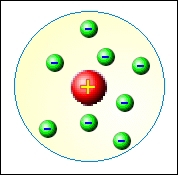
Atom utvořený na základě Rutherfordova modelu, by ale neměl dlouhé trvání. Elektron pohybující se po kruhové dráze se musí pohybovat s jistým dostředivým zrychlením. Protože jde o zrychlený pohyb nabité částice, dochází dle Maxwellových rovnic popisující vzniklé elektromagnetické pole, k vyzařování elektronu, což je v přímém rozporu s pozorováním. Navíc v důsledku vyzařování elektromagnetických vln elektron ztrácí energii, což se projevuje zmenšením poloměru dráhu. Za krátký čas 10−10 s by se elektron zřítil po spirálové dráze do jádra atomu. My ale ze zkušenosti víme, že atomy jsou útvary velmi stabilní.
Rutherfordova představa atomu se zdála být správná, nikomu se ale nedařilo na základě zákonů klasické fyziky uspokojivě vysvětlit, proč atomy nezáří a nedochází k poklesu drah elektronů.
Jinou cestou se vydal dánský fyzik Niels Bohr (1882 – 1962). Bohr se inspiroval úspěšným Planckovým vysvětlením vyzařování absolutně černého tělesa za pomoci kvantování energie. V roce 1913 formuloval Bohr nový model atomu, který vycházel ze tří jednoduchých předpokladů:
- Elektron se může bez vyzařování energie pohybovat kolem jádra jen po určitých kruhových kvantových drahách, tzv. orbitalech.
- Elektrony při pohybu po drahách splňujících kvantovací podmínku nevyzařují energii.
- Elektron přijímá nebo vyzařuje energii pouze při přechodu z jednoho orbitalu na druhý. Při přechodu na orbital vzdálenější od jádra energii přijímá, při návratu na bližší orbital energii vyzařuje.
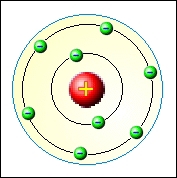
Bohrův model se dá poměrně dobře použít pro nejjednodušší atom vodíku. Zcela ale selhává při pokusu o vysvětlení spekter u složitějších atomů a již vůbec neuvažuje jemnou spektrální strukturu. Tyto nedostatky ale nebyly hlavním důvodem k zavržení Bohrova modelu. Jemnou strukturu ve spektrech se podařilo vysvětlil v Sommerfeldově modelu atomu, který využíval postupů klasické fyziky s využitím kvantovacích podmínek. Druhý problém víceelektronových atomů je obecný problém řešení úloh většího počtu vzájemně interagujících částic, ať už se jedná o klasickou nebo kvantovou fyziku.
Současně se zdokonalováním Bohrova modelu se vyvíjela i kvantová teorie, která byla obecně platnou a logickou teorií, ne pouze jednoúčelovým modelem. Hlavním důvodem zavržení Bohrova modelu nebyly tedy jeho nedostatky, ale jeho jednoúčelovost. Bohrův model (opravený na eliptické dráhy elektronů) se dodnes používá jako ukázka modelu atomu, je ale nezbytně nutné jej chápat pouze jako názorné schéma vnitřní stavby atomu a ne jako obraz toho, jak atom ve skutečnosti vypadá.
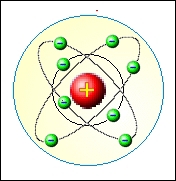
Cestu k novému plně kvantovému modelu atomu otevřel francouzský gymnaziální profesor Louis de Broglie (1892 – 1987) svým návrhem vlnové povahy hmoty. Jeho zcela nový pohled na částice jakožto malé vlny, zcela změnil dosavadní pohled na stavbu atomu.
Z de Brogleiho teorie hmotových vln elektronu později vycházel Erwin Schrödinger (1887 – 1961), když formuloval svůj plně kvantový model atomu (1926). Nezávisle na Schrödingerovi vypracoval vlastní kvantovou teorii také německý fyzik Karl Werner Heisenberg (1901 – 1976). Obě dvě formy kvantové mechaniky, vlnová Schrödingerova a maticová Heisenbergova, přestože vedly k stejným výsledkům, se z počátku zdály být zcela odlišné. V roce 1927 ukázal britský teoretický fyzik Paul Dirac (1902 – 1984), pomocí svého nového formalismu zápisu, který se v kvantové mechanice používá dodnes, ekvivalenci mezi Heisenbergovou a Schrödingerovou kvantovou teorií.
Pro grafické znázornění atomárních (molekulárních) orbitalů je nejvhodnější představa Schrödingerova. Schrödinger vlastně „dosadil“ de Brogleiho představu elektronových vln do obecné rovnice vlnění a po následných úpravách získal slavnou rovnici, která dostala jeho jméno.
Řešením Schrödingerovy rovnice je vlnová funkce Ψ, která zcela popisuje chování daného systému. Problém byl s interpretací vlnové funkce hmotné částice. U světelné vlny je čtverec amplitudy přímo úměrný intenzitě světla. Co ale znamená amplituda u vlny-částice? V analogii s představou fotonů (čím větší intenzita, tím více fotonů na dané místo dopadá), navrhl Max Born (1882 – 1970) interpretaci kvadrátu Ψ jako pravděpodobnost výskytu částice v daném objemovém elementu. Oblast atomu, ve které je pak hustota pravděpodobnosti výskytu elektronu největší, se nazývá atomový orbital. Řešením bezčasové části Schrödingerovy rovnice získáme sadu tří kvantových čísel (hlavní kvantové číslo n, vedlejší kvantové číslo l a magnetické kvantové číslo m), které určují tvar a energii atomových orbitalů.
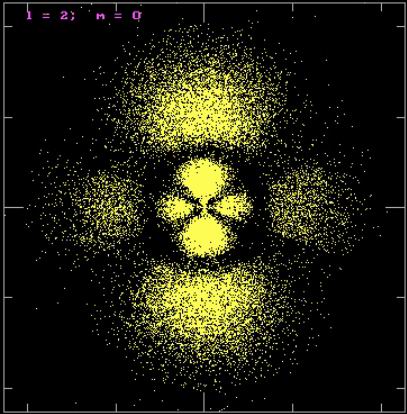
Kvantově mechanický popis vodíkového atomu. Orbital pro l = 2, m = 0.
Schrödingerův model atomu na rozdíl od všech předchozích již nepotřeboval žádné speciální předpoklady, ze kterých by plynulo následné kvantování. Kvantování zde přirozeně vyplývá z řešení Schrödingerovy rovnice. Shoda výsledků s experimentem byla uspokojivá, přesto se vyskytly jevy, které se ani za pomoci Schrödingerova modelu nepodařilo vysvětlit. Mezi nejpalčivější problémy patřila existence hyperjemné struktury ve spektrech atomů. Tu se podařilo vysvětlit až po objevení spinu elektronu.
Nejlidovější představa spinu elektronu je představa elektronu jako setrvačníku. Tato obecně přijímaná představa je ale zcela chybná. Spin elektronu je čistě relativistický efekt, který stejně jako náboj nebo hmotu elektronu musíme brát jako jeho přirozenou vlastnost. Pokud by tomu tak nebylo, elektron by díky své rotaci získal velkou kinetickou energii a neudržel by se na rotační dráze kolem jádra atomu, což je v přímém rozporu s pozorováním.
Konečnou relativistickou plně kvantovou teorii modelu atomu platnou s drobnými úpravami do dnešní doby představil již v roce 1928 Paul Dirac a rozšířil množství kvantových čísel určujících tvar a vlastnosti elektronového obalu atomu o spinové kvantové číslo.
V současné době se studiem molekul a chemických reakcí zabývá odvětví fyziky nazvané kvantová teorie molekul. Středem pozornosti této teorie jsou vlastnosti atomů, molekul a jejich vzájemné interakce jak ve stacionárních stavech (například optická spektra), tak ve stavech nestacionárních (chemické reakce). Vzhledem k rozměrům a časovým měřítkům je nezbytně nutné užití pouze kvantových a relativistických přístupů, klasická přiblížení jsou až na výjimky, jako atom vodíku a některé ionty, zcela nepoužitelná. V principu se vždy jedná o řešení příslušné Schrödingerovy (popřípadě Diracovy) rovnice. V obecném případě nelze nalézt přesné analytické řešení těchto rovnic, a proto se musíme omezit jen na přibližná nebo numerická řešení, která pak srovnáváme s experimentem.
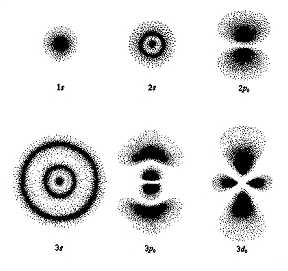
Elektronové orbitaly atomů
V případě atomů, ve kterých se elektrony pohybují v centrálním poli jádra, je řešení vlnové rovnice poměrně jednoduché. S využitím symetrie problémů v radiální proměnné lze nalézt stacionární stavy atomu, a ty pak bez obtíží numericky řešit. Příkladem takového symetrického problému je již zmíněný atom vodíku. U molekul je řešení vlnové rovnice obtížnější otázka. Jedná se totiž vždy o problém s nižší symetrií a zejména o problém s velkým počtem částic.
Pro chemické reakce jsou rozhodující pouze vnější valenční elektrony. Vnitřní elektrony se ve vazbě atomů v molekulách uplatňují jen poměrně málo. Atomy se slučují v molekuly proto, že je to energeticky výhodnější než existence samostatných atomů. Podle hlavního příspěvku k tomuto energetickému rozdílu rozeznáváme několik typů vazeb. Kovalentní vazba je důsledek „delokalizace“ valenčních elektronů v molekule. Vzhledem k tomu, že se po sloučení atomů zvýší neurčitost v poloze valenčních elektronů, musí se podle Heisenbergových relací neurčitosti snížit jejich hybnost, a tím i celková energie systému. U chemicky neutrálních atomů, tzv. vzácných plynů, což jsou atomy, které mají plně zaplněny valenční orbitaly, se kovalentní vazba nemůže uplatnit. U takovýchto atomů se uplatňuje energeticky slabší dipólová interakce. Naopak iontová vazba vzniká u atomů, které nemají zcela zaplněn valenční orbital. Dochází zde k přesunu elektronů a následné elektrostatické interakci mezi takto vzniklými ionty. Poslední energeticky nejméně výhodná vazba je vazba vodíková. Vzniká v důsledku malého poloměru atomu vodíku. Díky tomu se atom vodíku může dostat blízko k ostatním vazebným atomům, což může vést k poklesu celkové energie.
Mnohačásticový problém molekul se snažíme obejít různými aproximacemi. Nejužívanější metoda je tzv. Bornova-Oppenheimerova aproximace, kdy místo jedné rovnice řešíme rovnice dvě. Nejprve pohyb elektronů v poli nehybných jader a poté pohyb jader v potenciálu pohybujících se elektronů. Případně nahradíme jádro s elektrony pod valenční slupkou odpovídajícími ionty. Další používaná metoda je například Hartree-Fockova metoda, což je jakási jednočásticová aproximace, kdy působení zbývajících elektronů nahradíme nějakým odpovídajícím efektivním polem.
Výše zmíněná řešení rovnic dávají pouze matematické modely atomových (molekulárních) orbitalů. Na konci minulého roku se týmu vědců vedených Davidem Villeneuvem z Národního výzkumného centra v kanadské Ottawě podařilo pomocí femtosekundového laseru pozorovat přímo vlnovou funkci valenčních elektronů molekuly N2 a následně zobrazit její 3D obraz. Získaný výsledek byl v dobré shodě s dosud užívanými modely založenými právě na některé z výše zmíněných aproximací. Otevřela se tak nová cesta k pozorování atomů a molekul na časové škále blízké rychlosti chemických reakcí.
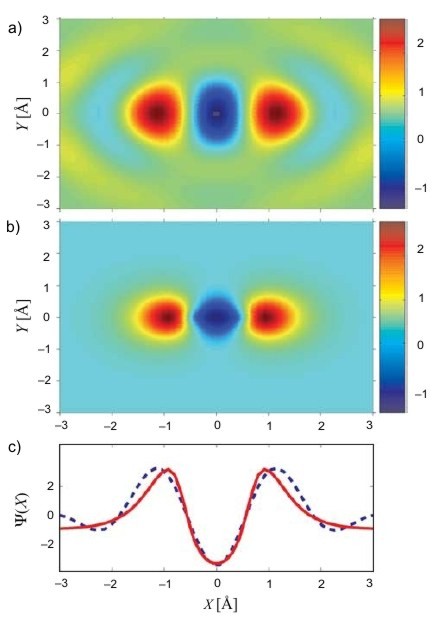
Molekulární orbital N2. a) Pozorovaná vlnová funkce orbitalu molekuly N2; b) molekulový orbital vypočítaný numericky ze Shrödingerovy rovnice (ab initio); c) příčný řez molekulou (červeně – ab initio, čárkovaně – pozorování).
To, jak jednotlivé atomy vypadají, víme již několik desetiletí. V roce 1981 Gerd Binning (*1947) a Heinrich Rohrer (*1933) sestrojili první rastrovací tunelový mikroskop, který umožnil pozorování reálného povrchu vzorku s rozlišením jednotlivých atomů. Na základě jejich mikroskopu byly vynalezeny další metody na zobrazování atomů. Mezi nejznámější patří STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem. (Řádkovací tunelová mikroskopie) a AFMMikroskop atomárních sil – AFM (Atomic Force Microscope). Zařízení skenuje povrch materiálu pomocí hrotu zavěšeného na pružném výkyvném raménku. Hrot je přitahován elektrostatickými a van der Waalsovými silami. Výkyvy raménka nad povrchem jsou sledovány laserem. AFM mikroskop není omezen na vodivé materiály jako STM mikroskop. AFM mikroskop byl vynalezen v roce 1986 G. Binnigem, C. Quatem a C. Gerberem. (Mikroskopie atomárních sil).
STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem. funguje na principu kvantového tunelového jevu. Přejížděním hrotu STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem. v malé vzdálenosti od zkoumaného vzorku a současným měřením změn tunelového proudu. Získáváme obraz lokální hustoty elektronů na povrchu vzorku. Z takto získaných map poté můžeme sestavit obraz uspořádání jednotlivých atomů ve zkoumaném vzorku. Velkou nevýhodou STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem. je jeho omezení pouze na vodivé materiály.
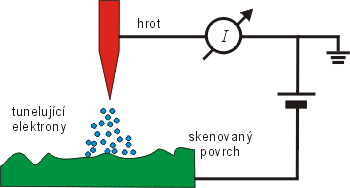
Schéma řádkovacího tunelového mikroskopu.
Metoda AFMMikroskop atomárních sil – AFM (Atomic Force Microscope). Zařízení skenuje povrch materiálu pomocí hrotu zavěšeného na pružném výkyvném raménku. Hrot je přitahován elektrostatickými a van der Waalsovými silami. Výkyvy raménka nad povrchem jsou sledovány laserem. AFM mikroskop není omezen na vodivé materiály jako STM mikroskop. AFM mikroskop byl vynalezen v roce 1986 G. Binnigem, C. Quatem a C. Gerberem. je založena na neelektrických přitažlivých a odpudivých silách mezi atomy. Odpadá zde tudíž omezující podmínka použití STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem. pouze na vodivé materiály. Princip spočívá opět ve skenování vzorku ostrým hrotem zavěšeným na pružném raménku. Ze změn polohy raménka pak můžeme zkonstruovat tvar povrchu.
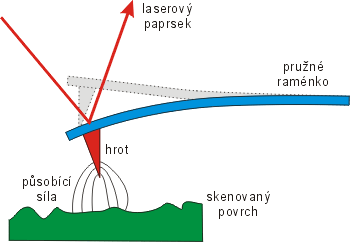
Schéma mikroskopu AFMMikroskop atomárních sil – AFM (Atomic Force Microscope). Zařízení skenuje povrch materiálu pomocí hrotu zavěšeného na pružném výkyvném raménku. Hrot je přitahován elektrostatickými a van der Waalsovými silami. Výkyvy raménka nad povrchem jsou sledovány laserem. AFM mikroskop není omezen na vodivé materiály jako STM mikroskop. AFM mikroskop byl vynalezen v roce 1986 G. Binnigem, C. Quatem a C. Gerberem..
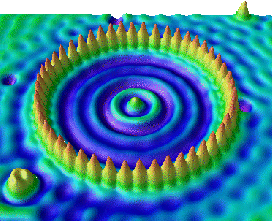

Nalevo: stojatá elektronová vlna v kruhu atomů
železa na povrchu mědi (STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem.).
Napravo:
Lidské chromozomy (AFMMikroskop atomárních sil – AFM (Atomic Force Microscope). Zařízení skenuje povrch materiálu pomocí hrotu zavěšeného na pružném výkyvném raménku. Hrot je přitahován elektrostatickými a van der Waalsovými silami. Výkyvy raménka nad povrchem jsou sledovány laserem. AFM mikroskop není omezen na vodivé materiály jako STM mikroskop. AFM mikroskop byl vynalezen v roce 1986 G. Binnigem, C. Quatem a C. Gerberem.).


Nalevo: vodivý hrot STMŘádkovací tunelový mikroskop – STM (Scanning Tunnelling Microscope). Zařízení mapuje povrch pomocí pohybu vodivého hrotu nad vodivým povrchem sledovaného materiálu. Množství elektronů, které tuneluje z materiálu do hrotu je exponenciálně závislé na vzdálenosti a pomocí měřeného proudu lze vykreslit mapu povrchu. STM mikroskop byl vynalezen v roce 1981 G. Binnigem a H. Rohrerem.. Napravo: pohyblivé raménko AFMMikroskop atomárních sil – AFM (Atomic Force Microscope). Zařízení skenuje povrch materiálu pomocí hrotu zavěšeného na pružném výkyvném raménku. Hrot je přitahován elektrostatickými a van der Waalsovými silami. Výkyvy raménka nad povrchem jsou sledovány laserem. AFM mikroskop není omezen na vodivé materiály jako STM mikroskop. AFM mikroskop byl vynalezen v roce 1986 G. Binnigem, C. Quatem a C. Gerberem..
Odkazy
B. Rezek: Zviditelňujeme atomy, FZÚ AV ČR, 1999
ČEZ: Miniencyklopedie jaderné energetiky
J. Iatani a kol.: Tomographic imaging of molecular orbitals, Nature 432 (2004) 867-871
L. Skála: Kvantová teorie molekul, UK Praha, 1995, ISBN 80-7184-007-6
J. Fišer, F. Zemánek: Struktura látek, UK Praha, 1994
D. Břeň, P. Kulhánek: Pikoškály aneb jak uvidět atom, Aldebaran Bulletin 27/2004
