|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Pátá forma uhlíku – nanopěna s feromagnetickými vlastnostmi
Martin Žáček
Když se řekne uhlík, vybaví se nám nejspíše jako první uhlí. Snad proto, že souvislost obou pojmů se promítla i do podobnosti jazykové a to nejen v našem jazyce. Další asociací může být třeba tuha tužky. Když si vzpomeneme na školské znalosti z chemie, uvědomíme si, že jde o lehký chemický prvek s atomovým číslem 6, nezbytný pro život, neboť je to nejdůležitější stavební článek všech živých organizmů. Je totiž obsažen nejen v bílkovinách, základních stavebních látkách všeho živého, ale i v cukrech a tucích, v nichž přijímáme energii v potravě. Pak mnohé napadne diamant. Že jde o pevnou látku složenou rovněž pouze z uhlíku, víme obvykle již jen ze školních znalostí, z vlastní zkušenosti by nás to asi nenapadlo a to nejen proto, že málo kdo z nás má nějaké ty diamanty doma. Jde o látku z téhož prvku avšak s výrazně odlišnými vlastnostmi. Zatímco grafit je látka relativně měkká, černé barvy a dá se s ní psát, diamant se naopak řadí na poslední místo empirické stupnice tvrdosti, je průhledný s vysokým indexem lomu a značnou optickou disperzí. Proto také dobře rozkládá bílé světlo na barevné. Tato vlastnost spolu s řídkým výskytem diamantové formy uhlíku na Zemi vedla k tomu, že se diamant vybroušený do tvaru briliantu stal nejdražším šperkem patřícím na koruny králů a označujícím míru společenské prestiže a postavení. Postupem doby se stal diamant vzhledem k jeho tvrdosti také důležitým materiálem pro využití v technologiích a naučili jsme se ho díky pokroku v termodynamice, fyzikální chemii a fyzice pevných látek uměle vyrábět. Stejně jako u zlata se o tento cíl neúspěšně pokoušely generace středověkých alchymistů, metoda "pokusů a omylů" bez hlubších teoretických znalostí se v tomto případě ukázala jako neúspěšná. V tomto článku ukážeme, že kromě snahy vyrobit známou látku se cesta poznání může ubírat tak, že připravenému vědeckému týmu se může podařit objevit strukturu zcela novou. Je k tomu třeba vědět, jakými metodami se má hledat a jaké parametry sledovat, abychom nový objev nepřehlédli.
|
Grafit – forma uhlíku s atomy tvořícími, podobně jako led, šestiúhelníkovou krystalovou mříž. Atomy v jedné rovině jsou propojeny v pravidelné šestiúhelníky do tvaru připomínajícího včelí plástve. Tyto roviny jsou pak řazeny nad sebou tak, že tři uzlové body (atomy) sousedních vrstev krystalové mříže jsou právě nad geometrickými středy šestiúhelníků sousední vrstvy a tři jsou v zákrytu. Vzdálenost mezi vrstvami je 0,336 nm, strana šestiúhelníka 0,2464 nm, hustota grafitu je 2,26 g/cm3. Animace mřížky (avi, 8 MB). Diamant – forma uhlíku s diamantovou krystalovou mříží. Sousední vazby (tzv. σ vazby) svírají úhel 109°28′ a jejich délka je 0,154 nm. Za normálních podmínek je teplota tání 3 500 °C, hustota 3,51 g/cm3 a index lomu n = 2,417. Animace mřížky (avi, 2.6 MB). Fullereny – sférické struktury tvořené atomy uhlíku, rozměr této obří molekuly je kolem 0,7 nm. Nejdůležitější z fullerenů jsou C60, C50 a C70 obsahujících 60, 50 a 70 atomů uhlíku. Fullereny za normálních podmínek sublimují při teplotách nad 500 °C. Krystalová mříž – pravidelné, periodické uspořádání atomů takové, že rovnoběžným posunutím o celočíselný násobek základní periody získáme tutéž strukturu. Směry, ve kterých toto nastává v případě posunutí o základní periodu, nazýváme hlavní směry mřížky, roviny na tyto směry kolmé nazýváme krystalografickými rovinami. Další třídu symetrií získáme kromě posunutí také otočením. Rentgenovou difrakcí zřetelně odhalíme krystalovou strukturu, neboť stopy rentgenových paprsků odražených od povrchu zkoumané látky vytvoří na filmovém materiálu ohybový obrazec, charakteristický pro každý typ krystalové struktury. Amorfní látka – látka, u které chybí pravidelné uspořádání atomů, rentgenovou difrakcí u této látky získáme pouze difúzní obrazec, svědčící o nahodilém uspořádání bez pravidelné struktury. Zakázaný pás – interval energie ve kterém se nemůže nacházet žádný ze stavů elektronů v krystalové mříži. Podle šířky zakázaného pásu rozdělujeme látky na vodiče (mají nulovou šířku zakázaného pásu), polovodiče (zakázaný pás nenulový avšak menší než 3 eV) a izolanty (zakázaný pás je větší jak 3 eV). Elementární buňka – nejmenší možný mnohostěn, jehož posunutím v hlavních směrech je možné vyplnit celý prostor a vygenerovat celou strukturu krystalové mříže. Mřížková konstanta – vzdálenost sousedních atomů v krystalové mříži. |
Různé formy uhlíku
Čím je dáno, že týž prvek může vytvářet různé modifikace s tak odlišnými vlastnostmi? Na tuto otázku odpovídá fyzika pevných látek, podobor a zároveň aplikace kvantové teorie. Makroskopické vlastnosti, jak mechanické tak optické i elektrické jsou dány konfigurací elektronových obalů atomů v krystalové mříži. Jsou-li atomy tak blízko u sebe, že vymizí zakázaný pás a elektrony mohou přecházet z vázaných stavů na volné, látka je vodivá, neprůhledná a světlo odráží, jak je tomu třeba u grafitu. Naopak, jsou-li atomy v geometrickém uspořádání s nenulovým zakázaným pásem, látka je nevodivá, světlo nejen že neodráží, dokonce může být i průhledná. Takové vlastnosti má diamant. Zatímco u grafitu tvoří krystalickou mřížku jakési pláty uspořádané na sobě, snadno se dají od sebe oddělit a proto se s tužkou tak dobře píše, diamant má naopak ve své mříži velmi těsné uspořádání, atomy jsou v ní velice dobře drženy a s diamantovou "tužkou" můžeme řezat tak tvrdé materiály jako je sklo.
Diamant jako šperk a také obráběcí nástroj
Pokud uslyšíme, že pomocí uhlíku lze obrábět velmi tvrdé materiály, řekneme asi, že si to někdo spletl nebo že má příliš nerealistickou fantazii. Ovšem do doby, než specifikuje jakou formu uhlíku má na mysli. Hovoříme o diamantu. Pokud se za vhodných termodynamických podmínek podaří přinutit atomy uhlíku aby se přeskupily do jiného, těsnějšího uspořádání, podaří se nám jej vyrobit. Za jakých tlaků a teplot to může nastat, lze vyčíst z fázového diagramu uhlíku na obrázku.
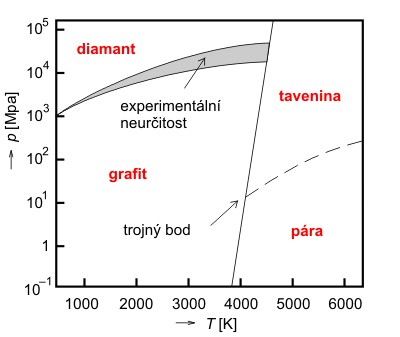
Fázový diagram uhlíku. Podle W. J. Moore: Fyzikální chemie, SNTL, Praha 1981.
Ke krystalizaci ochlazováním čisté uhlíkové taveniny bychom potřebovali tlakovou komoru, která vydrží tlak 20 GPa při teplotě 4000 K, což jsou zatím nedosažitelné podmínky. Výroba se však daří jiným způsobem. Pokud je v tavenině přítomen jiný, katalyticky působící kov, může vyrůst monokrystal diamantu už za teplot 1 700 až 1 800 K a tlaku 6 GPa. Další metodou výroby diamantů je dynamický ohřev rázovou vlnou. Odpadá zde problém tlakové komory se zmíněnými parametry, zato se však musíme vypořádat s tím, že po prudkém vzestupu teploty a tlaku následuje za rázovou vlnou opět pokles tlaku a vzniklé krystaly diamantu zase zaniknou a změní se v taveninu nebo na grafit.
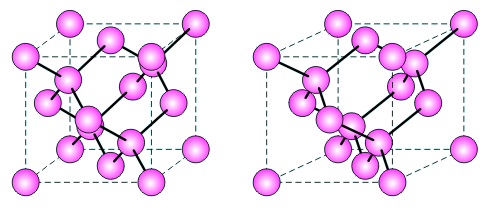
Prostorové znázornění diamantové krystalové mříže, nejtěsnějšího možného uspořádání atomů se čtyřmi vazbami. Spojnice znázorněné silnou čarou propojují sousední atomy nacházející se v nejkratší vzdálenosti od sebe, čárkovaně je vyznačena hranice elementární buňky. Prostorovou mřížku spatříte tak, že se podíváte na myšlený bod daleko za nákresnou, kdy levý obraz viděný levým okem splyne s pravým obrazem viděným pravým okem a vznikne iluze jediného, prostorového obrazu. Poté opatrně zaostříte na nákresnu a snažíte se, aby se prostorový obraz již nerozdělil. U krátkozrakých osob se to lépe podaří bez brýlí. Mnohem snadněji se efektu docílí, pozorujeme-li obrazy mřížky dvěma shodnými spojnými čočkami s vhodnou ohniskovou vzdáleností, umožňující zaostřit a pozorovat obraz z větší blízkosti.
Fullereny a nanotrubice
Fullereny jsou látky složené ze sférických molekul uhlíku tvořených jakousi dutou klecí z mnoha atomů. Jméno získaly podle amerického architekta a vynálezce Richarda Buckministera Fullera (1895-1983), který se proslavil podobnými stavebními konstrukcemi. První, šedesátiatomový fulleren byl syntetizován a objeven v roce 1985 britským vědcem Haroldem Krotem, který za tento objev dostal Nobelovu cenu za chemii. Nanotrubice jsou vlastně podobné struktury, s tím rozdílem, že tvar molekuly místo koule připomíná válec, který může být libovolně dlouhý a vnitřní objem nemusí být uzavřený. Pro nanotechnologii jsou jak fullereny tak nanotrubice velmi zajímavé, neboť lze tyto látky připravit v různých modifikacích s odlišnými vlastnostmi. U sférických fullerenových molekul lze například ovlivňovat vlastnosti tím, že je uvnitř uvězněn jiný atom. Tak lze změnit třeba hustotu, tepelnou kapacitu, teplotu tání a varu a přitom je látka co do chemických vlastností tatáž. Sférické fullereny byly již objeveny jak na Zemi tak v meteoritech.

Fulleren C60 - počítačem vytvořený obrázek.
Nanotrubice byly například úspěšně použity v mikroelektronice. U běžného, polem řízeného tranzistoru prochází proud regulovaný napětím hradla napařenou polovodičovou vrstvičkou. Mnohem technologicky vyspělejší nanouhlíkový tranzistor má však místo polovodiče použitu nanotrubici, přičemž lze dosáhnout mnohem lepších dymanických vlastností. Další jistě pozoruhodnou aplikací je fascinující spojení snad nejpopulárnějšího, více než 100 let starého vynálezu, Edisonovy žárovky s moderní nanotechnologií, kdy se zkoušelo použít vlákno z uhlíkových nanotrubic namísto tradičního wolframového vlákna. Uhlíková "nanožárovka" má lepší účinnost a životnost.
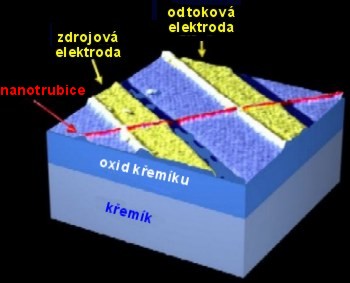
Polem řízený tranzistor využívající uhlíkovou nanotrubici (červeně) s průměrem 1 nm. Hlavní platinové elektrody (žlutě) nanesené na izolující vrstvu oxidu křemíku (modře) jsou od sebe vzdáleny 400 nm. Proud nanotrubicí je řízen napětím hradla, které není na obrázku znázorněno.

Žárovka s klasickým wolframovým a s uhlíkovým
vláknem
vyrobeným z nanotrubic.
Poslední objevená forma uhlíku - uhlíková nanopěna
Novou, poslední známou formu uhlíku se podařilo vytvořit týmu fyziků z australské národní laboratoře v Canbeře poté, co vystavili uhlíkový terčík v argonové atmosféře působení výkonného laserového pulsního systému. Mikrostruktura, jež se vytvořila po zahřátí na teplotu 10 000 °C, připomíná jakési vzájemně pospojované sítě uhlíkových trubiček, 5 nm dlouhých. Vědci tuto formu pevné látky nazvali nanopěnou. John Giapintzakis z univerzity na Krétě podrobil nanopěnu pečlivému zkoumání elektronovým mikroskopem, přičemž dospěl k závěru, že novou strukturu můžeme považovat za pátou formu uhlíku. Na výročním setkání Americké fyzikální společnosti 22. března 2004 v Montrealu Giapintzakis oznámil, že vzorky připravené z uhlíkové nanopěny mohou vykazovat feromagnetické vlastnosti, což je u látky z čistého uhlíku překvapivé. Všechny ostatní známé formy uhlíku se totiž až dosud chovaly jako nemagnetické. Efekt za pokojové teploty vymizí po několika hodinách, ale může se udržet mnohem déle za nízkých teplot. Podle Giapintzakise by bylo možné novou látku využít například v medicíně, když by se po vstříknutí látky do krevního oběhu mohl zviditelnit průtok krve tkání metodou jaderné magnetické rezonance. David Tomanek z Michiganské státní univerzity, který se zkoumáním uhlíkové pěny také zabývá, zase předpovídá, že by látka mohla posloužit při léčbě rakoviny. Po vstříknutí látky do nádoru by totiž bylo možné jej zničit lokálním zvýšením teploty po pohlcení infračerveného záření nanopěnou, zatímco okolní, zdravá tkáň by zůstala nepoškozena. Vlastnosti nové látky se zatím intenzivně zkoumají v laboratořích, ale lze očekávat, že se nové aplikace objeví brzy.

Uhlíková nanopěna, snímek elektronovým rastrovacím mikroskopem.
Odkazy
- Hrubý: Periodická tabulka prvků
- J. Giles: Scientists create fifth form of carbon, Nature science update
- B. Dumé: Nano-foam makes magnetic debut, Physics Web, March 2004
-
P. Schewe, B. Stein: Carbon Nanofoam is the First Pure-Carbon Magnet,
Physics News Update - R. F. Service: Carbon nanofoam, Science 304 (2004) 42; (pdf, 430 kB)
- Astronomický snímek dne (329): Fullereny z vesmíru
- www.nanomedicina.cz (www stránky, editor A. Reško)
- P. L. McEuen: Carbon–based electronics, Nature 393 (1998) 15; (pdf, 253 kB)
- B. Dumé: Nanobulbs make their debut, Physics Web, June 2004
- Jan Pašek: Může být diamant supravodivý za pokojové teploty?;
Aldebaran Bulletin 22 (2003). - Martin Žáček: Aerogely a kosmický prach; Aldebaran Bulletin 40 (2003).
