|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Obří Rydbergovy molekuly
Petr Kulhánek
Fyzika vysoce excitovaných atomů s velkými rozměry zažívá v posledních letech neuvěřitelný rozmach a nacházejí se další a další aplikační možnosti. Atomům excitovaným do vysokých energetických stavů říkáme Rydbergovy atomyRydbergův atom – atom excitovaný do vysokého hlavního a vedlejšího kvantového čísla. Rydbergovy atomy jsou velmi citlivé na okolní elektrická a magnetická pole. Elektronová vlnová funkce může být u některých superpozic stavů těchto atomů aproximována klasickým pohybem elektronu po kružnici. Vysoce excitované atomy jsou pojmenovány podle švédského fyzika Johannese Roberta Rydberga (1854–1919).. Mnohdy je lze považovat za makroskopické objekty. Vždyť vodíkovýVodík – Hydrogenium, je nejlehčí a nejjednodušší plynný chemický prvek, tvořící převážnou část hmoty ve vesmíru. Má široké praktické využití jako zdroj energie, redukční činidlo při chemické syntéze a v metalurgii nebo jako náplň balonů a vzducholodí. Vodík objevil roku 1766 Henry Cavendish. atom excitovaný do stavu s hlavním kvantovým číslemKvantové číslo, hlavní – značíme n, čísluje energii systému En. Hodnota energie závisí na průběhu potenciální energie. Energie je proto jinak kvantována ve vodíkovém atomu, jinak v harmonickém oscilátoru, kvantové jámě, atd. 137 má rozměr jeden mikrometr, což je desettisíckrát větší velikost, než jakou mají běžné atomy. A pokud by se nám podařilo excitovat draslíkDraslík – Kalium, velmi důležitý a reaktivní prvek ze skupiny alkalických kovů, hojně zastoupený v zemské kůře, mořské vodě i živých organizmech. Draslík je měkký, lehký a stříbrolesklý kov, který lze krájet nožem. Volný kov se poprvé podařilo připravit roku 1807 siru Humphry Davymu. do stavu s hlavním kvantovým číslem 600, měl by rozměr desetinu milimetru. Nejčastěji pro přípravu Rydbergových atomů využívá cesiumCesium – Caesium, chemický prvek ze skupiny alkalických kovů, vyznačuje se velkou reaktivitou. Cesium je měkký (měkkčí než vosk), lehký a zlatožlutý kov, který lze krájet nožem. Na rozdíl od ostatních alkalických kovů je spolu s rubidiem těžší než voda. Velmi dobře vede elektrický proud a teplo. Cesium bylo objeveno roku 1860 německým chemikem Robertem W. Bunsenem a německým fyzikem Gustavem R. Kirchhoffem. nebo rubidiumRubidium – prvek ze skupiny alkalických kovů, vyznačuje se velkou reaktivitou. Rubidium je měkký (asi jako vosk), lehký a stříbrolesklý kov, který lze krájet nožem. Na rozdíl od předchozích alkalických kovů je těžší než voda. Velmi dobře vede elektrický proud a teplo. Rubidium bylo objeveno roku 1861 německým chemikem Robertem W. Bunsenem a německým fyzikem Gustavem R. Kirchhoffem. excitované do stavu s hlavním kvantovým číslem 10 až 50. Vyrobit Rydbergův atom není nic jednoduchého. Atomy musí být drženy v nějaké pasti, ochlazeny na teplotu blízkou absolutní nule (to se zpravidla dělá technologií laserového ochlazováníLaserové ochlazování – technika využívající k ochlazování atomů laserového světla s vlnovou délkou nepatrně nižší než je charakteristický elektronový přechod v atomu. Toto „podladění“ má za následek, ža atomy absorbují větší množství fotonů, pokud se pohybují směrem ke zdroji, než pokud se pohybují od zdroje. Při interakci s fotonem atom ztrácí odpovídající hybnost ve směru zdroje světla. Při následném vyzáření fotonu sice hybnost opět získá, ale v náhodném směru. Zpravidla se používá šest laserů ve směru a proti směru tří souřadnicových os. Ať se atom vydá kamkoli, vždy proti němu bude svítit laser se správně posunutou frekvencí. Mnohonásobným opakováním lze shluk atomů ochladit na nanokelvinové teploty. V roce 1997 byla za tento objev udělena Stevenovi Chuovi, Claudeovi Cohen-Tannoudjimu a Williamovi Philipsovi Nobelova cena za fyziku.) a excitovány pomocí laserovýchLASER – Light Amplification by Stimulated Emission of Radiation, zesílení světla pomocí stimulované emise záření. Roku 1958 ukázal Charles Hard Townes spolu s Arthurem Leonardem Schawlowem, že je možné zkonstruovat podobné zařízení jako již existující MASER (pracuje v mikrovlnné oblasti) také pro světlo. První laser zkonstruoval Theodore Harold Maiman v roce 1960. Aktivním prostředím byly ionty chrómu v syntetickém rubínovém krystalu. impulzů do vysokého energetického stavu. Teprve poté je možné je využít k zajímavým experimentům. V Aldebaran bulletinu se Rydbergovými atomy zabýváme pravidelně (viz například AB 31/2008, AB 12/2012 nebo AB 10/2016). Dnes si povíme o dalším významném experimentu, při němž byly připraveny dvouatomové molekuly (tzv. dimery) s rozměrem přes jeden mikrometr, tedy velikostí srovnatelnou s běžnou bakterií.

Rydbergův kvantový krystal. Normální atomy (zeleně) jsou uspořádány na optické mřížce. Některé z nich byly laserovým impulzem excitovány do Rydbergova stavu. Jsou znázorněny jako obří fialové koule. Zdroj: Immanuel Bloch.
|
Rydbergův atom – atom excitovaný do vysokého hlavního a vedlejšího kvantového čísla. Rydbergovy atomy jsou velmi citlivé na okolní elektrická a magnetická pole. Elektronová vlnová funkce může být u některých superpozic stavů těchto atomů aproximována klasickým pohybem elektronu po kružnici. Vysoce excitované atomy jsou pojmenovány podle švédského fyzika Johannese Roberta Rydberga (1854–1919). Laserové ochlazování – technika využívající k ochlazování atomů laserového světla s vlnovou délkou nepatrně nižší než je charakteristický elektronový přechod v atomu. Toto „podladění“ má za následek, ža atomy absorbují větší množství fotonů, pokud se pohybují směrem ke zdroji, než pokud se pohybují od zdroje. Při interakci s fotonem atom ztrácí odpovídající hybnost ve směru zdroje světla. Při následném vyzáření fotonu sice hybnost opět získá, ale v náhodném směru. Zpravidla se používá šest laserů ve směru a proti směru tří souřadnicových os. Ať se atom vydá kamkoli, vždy proti němu bude svítit laser se správně posunutou frekvencí. Mnohonásobným opakováním lze shluk atomů ochladit na nanokelvinové teploty. V roce 1997 byla za tento objev udělena Stevenovi Chuovi, Claudeovi Cohen-Tannoudjimu a Williamovi Philipsovi Nobelova cena za fyziku. Kvantové číslo, hlavní – značíme n, čísluje energii systému En. Hodnota energie závisí na průběhu potenciální energie. Energie je proto jinak kvantována ve vodíkovém atomu, jinak v harmonickém oscilátoru, kvantové jámě, atd. Kvantové číslo, vedlejší – značíme l, vyjadřuje maximální možnou projekci momentu hybnosti do nějaké osy v jednotkách redukované Planckovy konstanty. U atomu vodíku nabývá vedlejší kvantové číslo hodnot 0, 1, ... n–1. Časté je označování vedlejšího kvantového čísla písmeny s, p, d, f..., které odpovídají hodnotám 0, 1, 2, 3... Velikost momentu hybnosti (nikoli projekce) je dána vztahem L2 = l(l+1)ħ2. Kvantové číslo, magnetické – značíme m, čísluje projekci momentu hybnosti do libovolného směru. Ta může nabývat celistvých násobků Planckovy konstanty ħ, tedy Lk = mħ. LS vazba – spinorbitální interakce. Každý objekt má orbitální (l) a spinový (s) moment hybnosti. V kvantové teorii se oba momenty skládají do výsledného momentu hybnosti, který je charakterizován kvantovým číslem j nabývajícím hodnot od |l−s| do |l+s|. |
Rydbergovy atomy
První jednoduchou empirickou formuli pro spektrální čáry vodíku objevil švýcarský teoretický fyzik Johann Jakob Balmer v roce 1885. O pouhé tři roky později, v roce 1888, ji zobecnil švédský fyzik Johannes Rydberg. V roce 1913 formuli odvodil dánský fyzik Niels Bohr z postulátu, že se elektron v atomárním obalu nachází jen v určitých diskrétních stavech. Úplné kvantově-mechanické odvození provedl švýcarsko-rakousko-americký teoretik Wolfgang Pauli až v roce 1926. Elektrony v atomech mohou mít jen diskrétní záporné energie, které jsou číslovány tzv. hlavním kvantovým číslem. Vyšší číslo znamená vyšší energii. Elektron je vázaný, proto je jeho energie v atomu záporná a se zvyšujícím se hlavním kvantovým číslem roste k nule. Vzdálenosti mezi jednotlivými stavy jsou stále menší a menší a teoreticky by bylo možné dosáhnout víceméně jakéhokoli hlavního kvantového čísla a limitně se s energií elektronu přiblížit k nule. Nulovou nebo kladnou energii má volný elektron, který se od jádra může vzdálit do nekonečna. Atomy s vysokým hlavním kvantovým číslem mají nenulovou pravděpodobnost výskytu elektronu i ve velkých vzdálenostech od jádra. Takovým atomů říkáme Rydbergovy atomy.
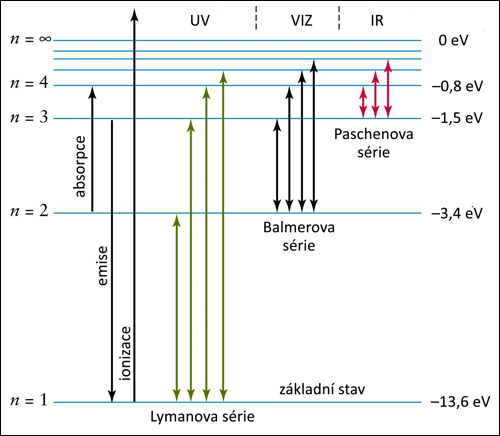
Energetické stavy ve vodíku. Nalevo je hlavní kvantové číslo n, napravo jemu odpovídající energie elektronu v elektronvoltech. Spektrální čáry vznikají přeskokem elektronu mezi dvěma hladinami a vytvářejí tzv. série, z nichž tři jsou zobrazeny na tomto grafu. Zdroj: UGA.
Stavy Rydbergových atomů zapisujeme trojicí symbolů nlj. Na prvním místě je hodnota hlavního kvantového čísla. Následuje ji vedlejší kvantové číslo vyjádřené písmenem a poslední číslo popisuje celkový momentu hybnosti (je dán kombinací spinu a orbitálního momentu, tzv. LS vazbouLS vazba – spinorbitální interakce. Každý objekt má orbitální (l) a spinový (s) moment hybnosti. V kvantové teorii se oba momenty skládají do výsledného momentu hybnosti, který je charakterizován kvantovým číslem j nabývajícím hodnot od |l−s| do |l+s|.). Například Rydbergův atom ve stavu 50p3/2 má hlavní kvantové číslo 50, vedlejší čísloKvantové číslo, vedlejší – značíme l, vyjadřuje maximální možnou projekci momentu hybnosti do nějaké osy v jednotkách redukované Planckovy konstanty. U atomu vodíku nabývá vedlejší kvantové číslo hodnot 0, 1, ... n–1. Časté je označování vedlejšího kvantového čísla písmeny s, p, d, f..., které odpovídají hodnotám 0, 1, 2, 3... Velikost momentu hybnosti (nikoli projekce) je dána vztahem L2 = l(l+1)ħ2. je p, tedy 1 (maximální projekce orbitálního momentu hybnosti může být 1h). Celkový moment hybnosti má kvantové číslo j = 3/2, tj. maximální projekce celkového momentu hybnosti (spinu 1/2 a orbitálního momentu 1) je 3/2h. Obecně může j nabývat hodnot mezi |l−s| a |l+s|, takže bude existovat i stav 50p1/2. Ale dosti čísel, která charakterizují stav atomu, přejděme k samotným vlastnostem Rydbergových atomů.
Rydbergovy atomy lze připravit v tzv. kruhových stavech, kdy je pravděpodobnost výskytu elektronu na jeho „trajektorii“ všude stejná, takže je záporný náboj v obalu rovnoměrně rozprostřen a atom má nulový dipólový moment. Lze ale připravit i Rydbergovy atomy v superpozici dvou nebo více stavů, kde je v určitém místě vyšší hustota pravděpodobnosti výskytu elektronu. Toto místo zvýšené pravděpodobnosti výskytu elektronu obíhá kolem jádra. Výsledkem je nenulový rotující dipólový moment atomu. Takový atom připomíná Bohrův planetární model atomu – elektron jakoby obíhal jádro (viz AB 31/2008). Takové atomy jsou schopné snadno interagovat s okolím (prostřednictvím dipólového momentu) a jsou velmi citlivé na elektromagnetické pole. Serge Haroche využil Rydbergovy rotující dipóly k nedestruktivní detekci počtu fotonů v mikrovlnné dutině (viz AB 10/2016), kde se fáze otáčení dipólu změnila podle počtu přítomných fotonů. Platí ale i obrácená možnost: fotony s vhodnou frekvencí mohou snadno změnit stav Rydbergova atomu, přivést ho do superpozice stavů atd. Zkrátka pomocí fotonů generovaných laserem s přesně definovanou vlnovou délkou můžeme Rydbergovy atomy ovládat a manipulovat s nimi.
Existuje mnoho velmi zajímavých experimentů s Rydbergovými atomy z poslední doby, zmiňme na ukázku alespoň dva. Prvním jsou magnetické krystaly – vědcům z Max Planck Institutu se podařilo větší množství Rydbergových atomů donutit k tomu, aby se seřadily do periodické mříže a vytvořily velmi atypický magnet. Druhým příkladem jsou kvantové počítače – šlágr moderní doby. Jedna z realizací využívá Rydbergovy atomy jako nositele nositelé kvantové informace (qubityQubit – kvantová verze bitu neboli kvantový bit, základní jednotka informace podléhající kvantové logice. Klasický bit je buď ve stavu |0⟩, nebo |1⟩. Qubit zahrnuje navíc všechny superpozice α|0⟩+β|1⟩. Konkrétní hodnotu |0⟩, nebo |1⟩ nabude teprve v okamžiku měření. Element kvantové informace zavedl Benjamin Schumacher roku 1995. Na qubit lze také pohlížet jako na virtuální částici a v analogii k antičásticím lze zavést rovněž antiqubit nesoucí zápornou informaci.). Ve stuttgartském 5th Institute of Physics se vědcům podařilo ve skle vytvořit síť mikrokomůrek s atomy, které pak laserem přivedli do Rydbergova stavu. Vzniklé qubity ovládali pomocí laserových impulzů, přivedli je do propletených stavů a donutili přenášet informaci. Zdá se, že Rydbergovy atomy budou stát u mnoha technologií budoucnosti.

Optická laboratoř, v níž vytvářeli magnetické krystaly z
Rydbergových atomů.
Zdroj: MPI.
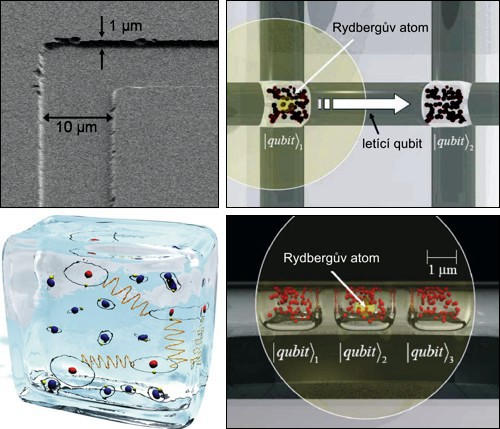
Základ kvantového počítače budovaný v 5th Institute of Physics ve Stuttgartu. Prostor pro síť qubitů je leptán litograficky do skla. Qubity v mikrokomůrkách ve skle jsou realizovány jako atomy excitované laserem do Rydbergových stavů. Vlevo dole je umělecká představa qubitů „zamrzlých“ ve skle. Zdroj: [10].
Rydbergovy molekuly
Rydbergovy atomy spolu mohou interagovat prostřednictvím dipól-dipólové interakce, případně prostřednictvím ještě vyšších momentů elektrického pole. Takovým silám říkáme Van der Waalsovy síly a v určitých případech, když má jejich potenciál minimum, mohou vést k vazbě. Existence dvojatomárních molekul složených z Rydbergových atomů byla předpovězena v numerických simulacích už v roce 2002. V roce 2009 došlo k první nepřímé detekci takové molekuly, nicméně bez podrobnějšího měření. Týmu odborníků z švýcarského Federálního institutu technologií ETH (pracoval v něm kdysi i Albert Einstein) se podařilo v roce 2016 obří dimery nejenom připravit, ale nalézt v excitačním spektru Rydbergových atomů i pík odpovídající vazebné energii (jejich typický spektrální podpis) a proměřit některé vlastnosti. Své experimenty prováděli s cesiovými atomy ochlazenými za pomoci laserového ochlazování na pouhých 40 µK. Pomocí laserových pulzů se jim podařilo část atomů excitovat na Rydbergovy atomy s n = 44. Následoval druhý pulz s ΔE < E44 − E43, jehož energie byla srovnatelná s předem spočtenou vazebnou energií. Průměrná vzdálenost mezi Rydbergovy atomy byla přibližně 1 μm, což odpovídalo zhruba délce vazby. Za těchto podmínek některé dvojice Rydbergových atomů vytvořily vázaný stav se vzdáleností atomů přes jeden mikrometr, což je desettisíckrát více než u molekuly kyslíku. Překryv elektronových orbitalů byl přitom minimální, takže nelze u této vazby hovořit o sdílení elektronů, atomy jsou od sebe výrazně separovány. Střední doba života připravených obřích molekul (tzv. makrodimerů) byla kolem jedné mikrosekundy.
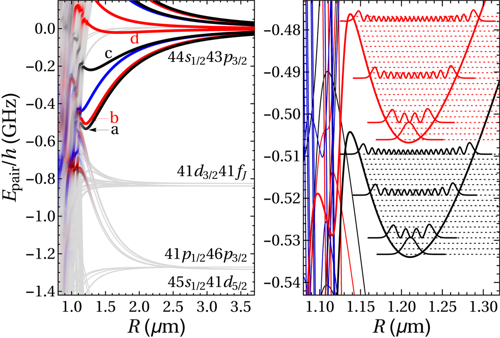
Nalevo je potenciální energie dvou cesiových Rydbergových atomů vypočtená pomocí numerické simulace. Křivky a až d mají energetické minimum a může dojít k vazbě. Napravo jsou zvětšená minima křivek a (černě) a b (červeně). Uvnitř minim jsou zakresleny hustoty pravděpodobnosti prvních čtyř vibračních stavů. Délka vazby je v obou případech přibližně 1,2 mikrometru. Zdroj: ETH.
Závěr
Poznávání kvantového světa na škálách představitelných pro člověka patří k jedněm z nejúžasnějších fenoménů současnosti. Kam povede fyzika Rydbergových atomů v několika příštích letech, lze jen těžko odhadnout. Jisté je, že může podstatně ovlivnit technologie přenosu informace, přinést zcela nové nedestruktivní metody měření, umožnit přípravu materiálů netušených vlastností a zejména přiblížit kvantový svět lidským měřítkům. Znovu a znovu se opakuje situace, kdy lidské poznání předčí i nejodvážnější představy spisovatelů vědeckofantastických románů.

Kresba připraveného makrodimeru v porovnání s velikostí bakterie. Zdroj: PRL/ETH.
Odkazy
- Heiner Saßmannshausen, Johannes Deiglmayr: Observation of Rydberg-Atom Macrodimers: Micrometer-Sized Diatomic Molecules; Physical Review Letters 117, 083401 (2016)
- Sophia Chen: Giant two-atom molecules are the size of bacteria; Physics World, 25 Aug 2016
- Keith Cooper: The rise of Rydberg physics; Physics World, 7 Apr 2016
- Petr Kulhánek: Nedestruktivní detekce fotonu; AB 10/2016
- David Břeň: Rydbergovy atomy simulují trojanské asteroidy; AB 12/2012
- Petr Kulhánek: Návrat planetárního modelu atomu; AB 31/2008
- Sigrid Ina Simonsen: Exploring Rydberg quasimolecules; IOP Science 2011
- M. Kiffner: Interacting Rydberg atoms experience artificial magnetic field; IOP Science 2013
-
P. Schauß et
al.: Crystallization in Ising quantum magnets;
Science 347 (6229), 1455-1458, 27 Mar 2015 - 5th Institute of Physics: µ-cell, 2015
- Laboratoire Kastler Brossel: Rydberg quantum engineering lab
-
D. Booth et
al.: Production of trilobite Rydberg molecule dimers with
kilo-Debye permanent electric dipole moments; Science 348 (6230),
99-102,
3 Apr 2015
